
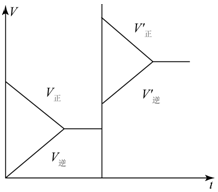
 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | X、Y中之一为气体,Z、W为非气体 | ||
| C. | X、Y、Z、W皆为气体 | D. | X、Y为气体,Z、W中之一为气体 |
分析 由图可知,增大压强,正逆反应速率均增大,则反应物、生成物均有气体,且正反应速率大于逆反应速率,则X+Y?W+Z为气体体积减小的反应,即生成物中有一种不是气体,以此来解答.
解答 解:A.Z、W为气体,X、Y中之一为气体,增大压强平衡逆向移动,逆反应速率大于正反应速率,与图象不符,故A不选;
B.X、Y中之一为气体,Z、W为非气体,增大压强,逆反应速率不变,与图象不符,故B不选;
C.X、Y、Z、W皆为气体,增大压强,正逆反应速率同等程度增大,与图象不符,故C不选;
D.X、Y为气体,Z、W中之一为气体,则增大压强,正逆反应速率均增大,且正反应速率大于逆反应速率,与图象一致,故D选;
故选D.
点评 本题考查反应速率与图象,为高频考点,把握压强对反应速率、平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图象中的速率变化,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铜分别与氯气完全反应,转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 平衡后升温,NO2含量降低 | 0~2s内,v(O2)=0.2mol•L-1•s-1 | v正:b点>a点,b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | .A. | B. | .B | C. | .C | D. | .D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物 氢氧化钙 Ca(OH)2 | B. | 酸性氧化物 二氧化碳 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 盐 烧碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯水100℃和25℃的pH值 | |
| B. | 氢硫酸溶液中的H+和HS-的浓度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 25℃,pH=11的KOH溶液与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
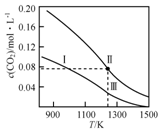 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)=2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 •H2O | B. | Na2CO3 •2H2O | C. | Na2CO3 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
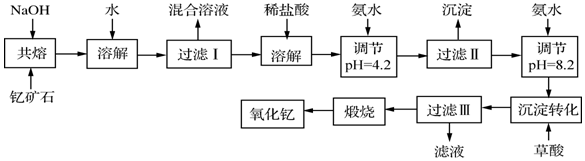
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com