
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因 |
分析 A.在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2;
B.同周期从左到右原子半径逐渐减小;
C.元素的最低负价是-4价,最高正价是+7价;
D.元素性质是由原子结构的周期性变化引起的.
解答 解:A.从第二周期开始,随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现,而在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2,故A错误;
B.同周期元素原子的电子层数相同,随着元素原子序数的递增,同周期从左到右原子半径逐渐减小,故B错误;
C.元素的最低负价是-4价,最高正价是+7价,随着元素原子序数的递增,一般情况下元素的最高正价从+1到+7,负价从-4到-1重复出现,故C错误;
D.元素性质是由原子结构的周期性变化引起的,即元素原子核外电子排布的周期性变化引起的,则原子半径、元素主要化合价和元素性质周期性变化的主要原因是元素原子核外电子排布的周期性变化,故D正确.
故选D.
点评 本题考查元素周期表和元素周期律知识,侧重于基础知识的考查,能很好地培养学生的良好的科学素养,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
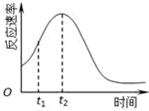 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
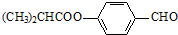 .合成M的一种途径如下:
.合成M的一种途径如下:
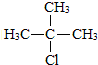 ,D中官能团的名称是羧基.
,D中官能团的名称是羧基.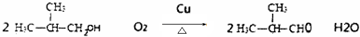 .
. .
.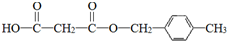 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
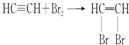
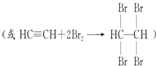 .
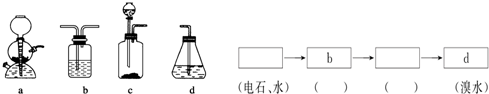
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(SO2):饱和NaHCO3溶液 | B. | NO(NO2):水 | ||
| C. | Cl2(HCl):NaOH溶液 | D. | Na2CO3固体(NaHCO3):加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
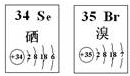
| A. | 原子半径:Br>Se>P | B. | 还原性:S 2 ->Se 2 ->Br - | ||
| C. | SeO 2既有氧化性又有还原性 | D. | 在Se2Br2分子中只含有极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com