
【题目】某同学通过以下流程制取 NaClO2晶体:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知:ClO2浓度过高时易发生分解,NaClO2高于60 ℃时易分解, NaClO2 饱和溶液在低于38 ℃时析出NaClO2·3H2O,高于38 ℃时析出 NaClO2。
下列说法不正确的是( )
A.步骤①中工业常用H2C2O4代替Na2SO3
B.步骤②发生反应的离子方程式为2ClO2+2OH-+H2O2===2ClO2-+O2+2H2O
C.步骤③的结晶方法为:蒸发浓缩,冷却结晶
D.步骤④中制得的NaClO2晶体中可用略高于38 ℃的热水洗涤2~3遍
【答案】C
【解析】
A项、步骤①中Na2SO3作为还原剂,H2C2O4也是常见的还原剂,工业常用H2C2O4代替Na2SO3,故A正确;
B项、步骤②发生的反应为碱性条件下ClO2与双氧水发生氧化还原反应生成ClO2-、O2和H2O,反应的离子方程式为 2ClO2+2OH-+H2O2=2ClO![]() +O2+2H2O,故B正确;
+O2+2H2O,故B正确;
C项、由于NaClO2高于60 ℃时易分解,因此结晶方法不可以用蒸发浓缩和冷却结晶的方法,应该用减压蒸发的办法,故C错误;
D项、由于NaClO2饱和溶液在低于38 ℃时析出NaClO2·3H2O,高于38 ℃时析出 NaClO2,步骤④中制得的NaClO2晶体中可用略高于38 ℃的热水洗涤2~3遍,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】判断正误![]() 正确的打“
正确的打“![]() ”,错误的打“
”,错误的打“![]() ”
”![]() 。
。
(1)阴、阳离子通过静电引力形成离子键____。
(2)离子化合物中一定含有金属元素____。
(3)由金属元素和非金属元素形成的化合物一定是离子化合物____。
(4)阴、阳离子间通过离子键一定能形成离子化合物____。
(5)![]() 属于离子化合物,其电子式为
属于离子化合物,其电子式为 ____。
____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断,下列说法中错误的是

A.该反应的△H大于0
B.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推知:凡是需要加热才能发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I锌粉法、II甲酸钠法。
Ⅰ.实验室模拟锌粉法的装置如下(加热等辅助仪器略去)
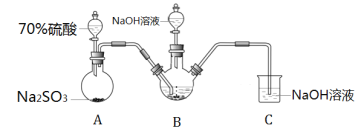
(1)第一步,将A中生成的气体通往B中进行反应,B中装的是颗粒度约为180m的锌粉与水形成的分散系,该分散系为___(填“溶液”、“胶体”或“悬浊液”)。在B装置生成连二亚硫酸锌的化学反应方程式为___。
(2)第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4和一种白色沉淀,沉淀的成分为___(写化学式)。
(3)第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出;用平衡移动的原理解释加入NaCl固体的作用是___。
第四步,过滤,用甲醇洗涤滤渣,干燥,得到Na2S2O4晶体。
II.实验室模拟甲酸钠法的装置如下(加热等辅助仪器略去)

第一步,在F装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体;
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F中制备连二亚硫酸钠的化学方程式可表示为___。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1≈4.4×10-7,K2≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为___。
甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图六个操作是常见物质的分离提纯操作,则有关这的说法不正确的是

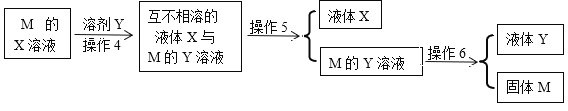
A. 操作1、操作2、操作6都可以是蒸馏,也可以是蒸发
B. 操作2可以是蒸发浓缩、冷却结晶、过滤
C. 操作3可以是洗剂、干燥
D. 操作4、操作5分别是萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )

A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧沉淀,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子B.Cl- 一定存在,且c(Cl-)≥0.4mol/L
C.SO42- 、NH4+一定存在,Cl- 可能不存在D.K+、CO32-一定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:
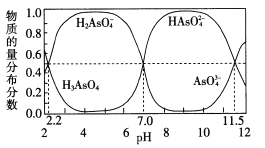
①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
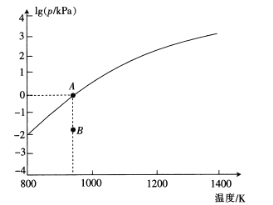
①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com