
����Ŀ�������������һ�ֿɴٽ�����������Ӫ�����ʡ���������ƿ�ͨ�����·�Ӧ�Ƶã�
C6H12O6(������)��Br2��H2O��C6H12O7(��������)��2HBr
2C6H12O7(��������)��CaCO3��Ca(C6H11O7)2(���������)��H2O��CO2
������ʵ��ܽ��Լ��±���
�������� | ��������� | �������� | �廯�� | �Ȼ��� |
ˮ�е��ܽ��� | ��������ˮ,��������ˮ | ���� | ���� | ���� |
�Ҵ��е��ܽ��� | �� | �� | ���� | ���� |
ʵ���������£�
��ش��������⣺��1���ڢٲ�����ˮ����������ʱ������װ������ʵ���________��
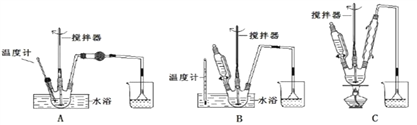
�Ʊ���������ƵĹ����У������ǵ�����Ҳ���������Լ����������������ʺϵ���________��
A������Cu(OH)2����Һ B������KMnO4��Һ
C��O2������������ø D��[Ag(NH3)2]OH��Һ
��2���ڢڲ���ַ�Ӧ��CaCO3��������ʣ�࣬��Ŀ����________����ʵ���в�����CaCl2���CaCO3��������________��
��3���ڢ۲�����ȹ��ˣ���ԭ����________��
��4���ڢܲ������Ҵ���������________��
�ڢ��У�����ϴ�Ӽ�����ʵ���________��
A����ˮ B����ˮ C���Ҵ� D���Ҵ���ˮ�����Һ
���𰸡� B C �����������Ƶ�ת���ʣ����ں�������
�Ȼ�����������������ֱ�ӷ�Ӧ�õ���������� �Ȼ�����������������ֱ�ӷ�Ӧ�õ���������� ��ֹ�����Ǹ�����ȴ���ᾧ��������߲��� ����������������ܼ��е��ܽ�ȣ���������������Ƶ����� D
�������������������1����Ӧ��55�������½��У���Ҫˮԡ���ȣ�������������װ�ã�����Aȱ�ٻ���װ�ã�Ҫ�μ���ˮ������Ҫ�е�Һ©�����ų�A��Cȱ��ˮԡ���ȣ�ֻ��B���ϣ�����Cu��OH��2����Һ��[Ag��NH3��2]OH��Һ�����Խ������ҷ�Ӧ��Ҫ���������½��У������������ǵ������������Ը�����������Խ�ǿ�����ܵõ��������ᣬ��������������ø�����������������������ǣ��������������ᣬ�𰸷ֱ�ѡB��C��
��2����ʹ����������ȫת��Ϊ��������ƣ�������̼���Ӧ���������������Ա���������ǿ��������Ȼ����������������Է�Ӧ�������������ʣ������룬Ӧ��̼��ơ�
��3���¶ȸ�ʱ����������Ƶ��ܽ�Ƚϴ��ȹ��ˣ��ɱ�����������Ƶ���ʧ��
��4���ɱ������ݿ�֪����������������Ҵ������Ҵ�ϴ�ӿɱ�����ʧ�����������������������
��5��ϴ�ӳ�����Ӧ��������ܽ⣬���ܽ������������ϴȥ�������Ҵ���ˮ�����Һ����ֻ��ˮ�����������������ܽ����ʧ��ֻ���Ҵ������ܽ�����ȫ��ϴȥ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M�ĺϳ�·������ͼ��ʾ:
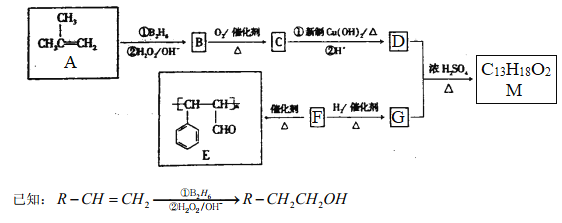
��ش���������:
��1���л���A��ϵͳ����Ϊ___________��
��2��F��E�ķ�Ӧ����Ϊ_________��B�����������ŵ�����Ϊ___________��
��3��M�Ľṹ��ʽΪ___________��
��4��C������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽΪ___________��
��5��F�ж���ͬ���칹�壬���к���������F������������ͬ��ͬ���칹����_____�֡�
��6������M�ĺϳ�·�ߣ����һ���ɱ�ϩ���Ҵ�Ϊ��ʼԭ���Ʊ����������ĺϳ�·��(���Լ���ѡ)___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��һ������Һ̬������XY2����һ������������ǡ����ȫȼ�գ��仯ѧ����ʽ��XY2(l)��3O2(g)![]() XO2(g)��2YO2(g) ��l����Һ�壬g�������壩
XO2(g)��2YO2(g) ��l����Һ�壬g�������壩
��ȴ���ڱ�״���²��������������672 mL���ܶ���2.56 g��L��1��
��1���۲췴Ӧǰ������Ļ�ѧ���������ɵ÷�Ӧǰ�����������__________��
��2��������XY2��Ħ��������__________��
��3����XY2������X��Y��Ԫ����������3:16����X��Y��Ԫ�طֱ�Ϊ__________��__________(��Ԫ�ط���)��
II�������£���20.0 g��������Ϊ14.0 %��KNO3��Һ��30.0 g��������Ϊ24.0 %��KNO3��Һ��ϣ��õ��ܶ�Ϊ1.15 gcm��3�Ļ����Һ�����㣺
��1����Ϻ���Һ����������___________��
��2����Ϻ���Һ�����ʵ���Ũ��____________(����һλС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������1��20��Ԫ���в���Ԫ����ɵĵ��ʻ��仯���ͼ�в��ַ�Ӧ����δ�г�����֪C��H����ɫ�д̼�����ζ�����壬D��һ�ֻ���ɫ�����嵥�ʣ�����J������Ӿ����������Ӧ�ں͢��ǻ��������е���Ҫ��Ӧ����Ӧ����ʵ�����Ʊ�����C����Ҫ������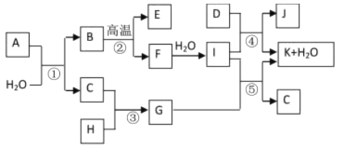
��ش��������⣺
��1��I��������ѧ������_______________��
��2��G��ˮ��Һ�����ԣ������ӷ���ʽ��ʾ��ԭ��_______________________
��3��ʵ�����Ʊ�����C�Ļ�ѧ����ʽ___________________________________________
��4����֪��7.4gI��ϡ��Һ��200mL1mol/L��H��Һ��Ӧ�ų�11.56kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ____________________________________________________
��5������A������Ԫ����ɣ�1 mol A��ˮ��Ӧ������1 mol B��2 mol C��A��ѧʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�� һ���¶�������1 L 0��l mol��L��1 CH3 COOH��Һ�м���0��1 molCH3COONa��������Һ��![]() __________________������������������С����������������
__________________����������������������������������
��2�������£���VmL��0.1000mol��L-1����������Һ��μ��뵽20.00mL��0.1000mol��L-1������Һ�У���ַ�Ӧ���ش��������⡣��������Һ����ı仯��
�������ҺpH=7����ʱV��ȡֵ___________20.00������>������<������=����������Һ�� c(Na+)��c(CH3COO-)��c(H+)��c(OH-)�Ĵ�С��ϵΪ_____________________________��
�����V=40.00�����ʱ��Һ��c(OH��) -c(H��) - c(CH3COOH)= _________mol��L-1��
��3�������£���20 ml 0��1mol��L��1 Na2CO3��Һ����μ���0��1mol��L��1 HC1��Һ40 mL����Һ�к�̼Ԫ�صĸ�������CO2���ݳ�δ���������ʵ�����������ҺpH�仯���������ͼ���ش��������⣺

������Na2CO3��NaHCO3����������Һ�������Һ��pH��ȡֵ��Χ��________________��
Ϊ�ⶨNa2CO3��NaHCO3������е��������������з������е���_________________
A��ȡa�˻�����ּ��ȣ�����b��
B��ȡa�˻����������ϡ�����ַ�Ӧ�����ȡ����ɡ����գ���b�˹���
C��ȡa�˻����������ϡ�����ַ�Ӧ���ݳ������ü�ʯ�����գ�����b��
D��ȡa�˻����������Ba(OH)2��Һ��ַ�Ӧ�����ˡ�ϴ�ӡ���ɣ���b�˹���
��������Һ�к��������������ӵ����ʵ���Ũ�ȵĴ�С��ϵΪ_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ���������У���ȷ����
A.���ӻ�������ܺ����ۼ�
B.���ۻ�������ܺ����Ӽ�
C.���ӻ�������ֻ�����Ӽ�
D.ֻ�л��ý�������÷ǽ���������γ����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. 0.01mol/L NH4Al(SO4)2��Һ��0.02mol/L Ba(OH��2��Һ��������:NH4����Al3����2SO42����2Ba2����4OH����2BaSO4����Al(OH)3����NH3��H2O
B. FeCl2������Һ���ڿ����б��ʣ�2Fe2����4H����O2=2Fe3����2H2O
C. ��CH3COOH�ܽ�CaCO3��CaCO3��2H��=Ca2����H2O��CO2��
D. ���MgCl2ˮ��Һ�����ӷ���ʽ��2Cl����2H2O![]() H2����Cl2����2OH��
H2����Cl2����2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���� �� ��
A. ��֪C(ʯī��s)��C(���ʯ��s) ��H��0������ʯ��ʯī�ȶ�
B. ��֪C(s)��O2(g)��CO2(g) ��H1 C(s)��1/2O2(g)��CO(g) ��H2������H2����H1
C. ��֪2H2(g)��O2(g)��2H2O(g) ��H����483.6 kJ/mol����������ȼ����Ϊ241.8 kJ/mol
D. ���ȹ���(��H��0)��������(��S�� 0)�Ĺ���һ�����Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ������Ӽ����ֺ��й��ۼ����ǣ� ��
A.CaCl2
B.H2O2
C.Na2S
D.NaOH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com