
分析 铜锌原电池中,较为活泼的金属锌为原电池的负极,发生氧化反应,正极为较不活泼的铜,发生还原反应,根据金属的性质和电解质溶液书写电极反应式.
解答 解:银锌原电池中,较为活泼的金属锌为原电池的负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,负极逐渐溶解,质量减小,正极为较不活泼的银,发生还原反应,铜离子在正极上得电子生成铜,电极反应为,Cu2++2e-=Cu,现象是析出红色的金属,
故答案为:负;氧化;Zn-2e-=Zn2+;逐渐溶解,质量减小;正;还原;析出红色的金属.
点评 本题考查了原电池原理,为高频考点,明确原电池中正负极上得失电子及发生的反应即可解答,难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
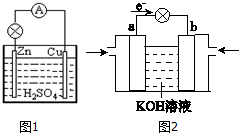 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠极易和水反应而被还原 | |
| D. | 钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:d>c>b>a | B. | 原子半径:r(A)>r(B)>r(D)>r(C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是氧化剂,FeCl3是还原剂 | |
| B. | 常温下,与56g Fe反应断裂1.5NA个Cl-Cl键 | |
| C. | 1 L 0.1 mol•L-1 FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 常温常压下,22.4 L Cl2和足量Fe反应转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 1mol石墨比1mol金刚石的总能量低 | D. | 1mol石墨比1mol金刚石的总能量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com