
【题目】一定温度下,在一定容积的密闭容器中加入NH3和O2各1mol,发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。下列说法中,表明该反应达到化学平衡状态的是
4NO(g)+6H2O(g)。下列说法中,表明该反应达到化学平衡状态的是
A. 反应速率不再变化 B. NH3和NO的反应速率相等
C. 气体的密度不再变化 D. NO和H2O浓度比不再变化
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2molO3和3molO2的质量之比为________,分子数之比为________,同温同压下的密度之比为________。
(2)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g,此混合物中CO和CO2物质的量之比是____,混合气体的平均相对分子质量是_____,对氢气的相对密度是____。
(3)19 gACl2中含有0.4 mol Cl-,则该氯化物的摩尔质量是_____;A的相对原子质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成金刚石的新方法化学原理为:①Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平);方法比人工首次制得金刚石的旧方法:②C(石墨)=C(金刚石)容易得多。以下表述中正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平);方法比人工首次制得金刚石的旧方法:②C(石墨)=C(金刚石)容易得多。以下表述中正确的是
A. 反应②中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是化学变化,旧方法利用的是物理变化
C. 在反应①中每生成12 g金刚石需要消耗46 g金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
A. 充电时,阳极附近pH值减小
B. 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
C. 放电时,负极上发生反应的物质是Fe(OH)2
D. 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组探究NO2性质,其实验装置如下图所示(夹持和固定装置省去)
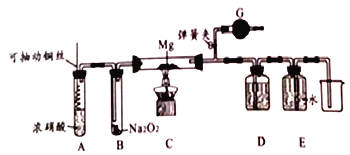
(1)铜与浓硝酸反应的离子方程式为__________,装置A的优点是______________。
(2)G中试剂为_________,作用是________________________。
(3)类比Mg与CO2反应的思路,写出Mg与NO2反应的化学方程式___________________,设计装置D(内装NaOH溶液)和装置E的目的是______________________。
(4)一段时间后,装置B中管壁发烫,瓶内红棕色物质消失,淡黄色粉末变成白色固体(为单一物质)。小组同学认为Na2O2与NO2发生了氧化还原反应,其结果有两种假设:
①NO2被Na2O2氧化,则白色固体是_______(填化学式)。
②NO2被Na2O2还原,为了验证此产物,取适量白色固体于试管中,加蒸馏水溶解,滴加酸性高锰酸钾溶液,则观察到的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入3mo1A和1molB,一定条件下发生反应3A(g)+B(g)![]() 2C(g)+D(g),达平衡时,测得C的浓度为wmol·L-1,若保持容器中容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为wmol·L-1的是
2C(g)+D(g),达平衡时,测得C的浓度为wmol·L-1,若保持容器中容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为wmol·L-1的是
A. 6molA+2molB B. 1.5molA-0.5molB+1molC+0.5molD
C. 3molA+1molB+2molC+1molD D. 1molB+2molC+1molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com