
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):分析 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1,而n=2,则A为N元素;E原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,则E为S元素;化合物B2E为离子化合物,B表现+1价,原子序数大于碳、小于硫,则B为Na;C元素是地壳中含量最高的金属元素,则C为Al;D单质常用于制作太阳能电池和集成电路芯片,则D为Si;F原子最外层电子数与B的相同,其余各内层轨道均充满电子,原子序数大于硫,处于第四周期,核外电子数为2+8+18+1=19,则F为Cu,
(1)A、B、E分别是N、Na、S元素,同一周期元素的第一电离能随着原子序数的增大而增大,同一主族,元素的第一电离能随着原子序数增大而减小;
(2)氢化物N2H4分子中,N原子价层电子对个数是4,且不含孤电子对,据此判断A原子杂化方式;
(3)F是Cu元素,在周期表的位置为第四周期第IB族,据此判断其所在区及基态原子的电子排布式;
(4)元素N和Al形成一种新型化合物材料,其晶体具有很高的硬度和熔点,说明该化合物是原子晶体,原子晶体中含有共价键;
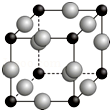
(5)N、Cu形成某种化合物的晶胞结构如图,利用均摊法确定化学式;
距离最近的两个F原子的核间距为a cm,则晶胞棱长为$\frac{\sqrt{2}}{2}$acm×2=$\sqrt{2}$acm,晶胞体积=($\sqrt{2}$acm)3,根据ρ=$\frac{m}{V}$计算该晶胞的密度.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1,而n=2,则A为N元素;E原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,则E为S元素;化合物B2E为离子化合物,B表现+1价,原子序数大于碳、小于硫,则B为Na;C元素是地壳中含量最高的金属元素,则C为Al;D单质常用于制作太阳能电池和集成电路芯片,则D为Si;F原子最外层电子数与B的相同,其余各内层轨道均充满电子,原子序数大于硫,处于第四周期,核外电子数为2+8+18+1=19,则F为Cu.
(1)N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离能:Na<S<N,
故答案为:Na<S<N;
(2)氢化物N2H4分子N原子形成2个N-H键、1个N-N键,还含有1对孤对电子,故N原子采取sp2 杂化,
故答案为:sp2;
(3)按原子的外围电子排布分区,元素Cu在ds区,基态Cu原子的核外电子总数为29,其基态原子的核外电子排布式为:1s22 s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:ds;1s22 s22p63s23p63d104s1或[Ar]3d104s1;
(4)元素N和Al可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,该化合物属于原子晶体,其化合物中所含的化学键类型为:共价键,
故答案为:共价键;
(5)A、F形成某种化合物的晶胞结构如图所示的立方晶胞(其中A显-3价,每个球均表示1个原子),
晶胞中小黑色球数目为8×$\frac{1}{8}$=1,大灰色球数目为12×$\frac{1}{4}$=3,其中N显-3价,则小黑色球为N原子、大灰色球为Cu,则其化学式为Cu3N;
设阿伏伽德罗常数为NA,晶胞质量为$\frac{64×3+14}{{N}_{A}}$g,距离最近的两个Cu原子的核间距为a cm,则晶胞棱长为$\frac{\sqrt{2}}{2}$acm×2=$\sqrt{2}$acm,
则该化合物的晶胞密度为:$\frac{\frac{64×3+14}{{N}_{A}}g}{({\sqrt{2a}cm)}^{3}}$=$\frac{103\sqrt{2}a}{2{a}^{3}{N}_{A}}$g/cm3,
故答案为:Cu3N;$\frac{103\sqrt{2}a}{2{a}^{3}{N}_{A}}$.
点评 本题考查了晶胞计算,题目难度中等,涉及核外电子排布、电离能、杂化方式、配合物、晶体类型与性质、晶胞计算等知识,明确原子结构与元素周期律、元素周期表的关系为解答关键,转移掌握均摊法在晶胞计算中的应用.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
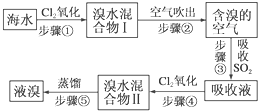
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ | |
| C. | 升高温度能使逆反应速率加快,正反应速率减慢 | |
| D. | 向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能起催化剂的作用 | B. | 受热分解能放出气体 | ||
| C. | 具有净水剂的作用 | D. | 在水中能起到酸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y(mol)与试剂体积x(mL)间的关系曲线如图所示.试回答:
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y(mol)与试剂体积x(mL)间的关系曲线如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
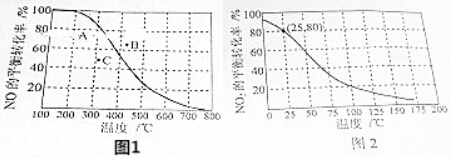
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com