
| A. | 鉴别胶体与浊液(丁达尔效应) | B. | 高压除尘(电泳现象) | ||
| C. | 河海交汇处可沉积沙洲(聚沉) | D. | 喷雾剂的应用(布朗运动) |
科目:高中化学 来源: 题型:填空题
 .
.| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
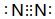 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化一定伴随着能量变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
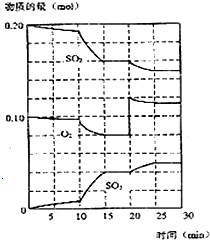 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com