
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
分析 Ⅰ.(1)①用研钵分别研细后再混合研磨,发生水解反应,有CO2气体生成,产生大量气泡,有“磁磁”的声音;
②根据SO42-的检验方法:先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-;
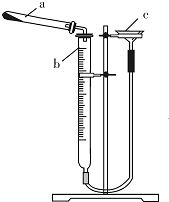
Ⅱ.(2)①根据常见仪器的结构写出名称;
②此装置漏斗与大气相通,要进行其气密性检查,首先要考虑的问题是如何使试管不直接通过量气管与大气相通,要解决这一问题,显而易见的用水(或液体)做液封,从而实现这一目的;
③先判断三次平行实验数据的有效性,然后求出平均值,然后根据方程式mCu(OH)2•nCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)CuO+mH2O+nCO2↑求出$\frac{m}{n}$的值;若量气管中所盛液体为水,二氧化碳溶于水,n值偏小,则m值偏大;
Ⅲ.(1)SO2气体通入CuCl2溶液中,生成CuCl沉淀,发生氧化还原反应,则S元素的化合价升高;
(2)2CuFeS2+4O2$\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO中,Cu、O元素的化合价降低,S元素的化合价升高,利用化合价变化计算被氧化的S;二氧化硫与碱反应可处理尾气;
(3)Cu元素的化合价由+1价升高为+2价,气体产物为NO和NO2的混合物,且体积比为1﹕1,得到电子数为1×(5-2)+1×(5-4)=4,Cu2O失去电子数为2,结合电子守恒及原子守恒分析.
解答 解:Ⅰ.(1)①用研钵分别研细后再混合研磨,发生水解反应,有CO2气体生成,产生大量气泡,所以会有“磁磁”的声音,
故答案为:有气体生成;
②滤液中是否含有SO42-的操作方法是:取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有,故答案为:取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-;
Ⅱ.(2)①仪器b的名称是碱式滴定管,故答案为:碱式滴定管;
②此装置漏斗与大气相通,要进行其气密性检查,首先要考虑的问题是如何使试管不直接通过量气管与大气相通,具体方法:连接好装置,通过漏斗向装置中加水,至漏斗中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气,
故答案为:连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不漏气,否则装置漏气;
③三次平行实验数据均有效,CO2体积的平均值$\frac{44.82+44.80+44.78}{3}$mL=44.80mL,物质的量为$\frac{0.0448L}{22.4L/mol}$=0.002mol,
mCu(OH)2•nCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)CuO+mH2O+nCO2
(98m+124n)g nmol
0.542g 0.002mol
解得:m:n=3:2;
若量气管中所盛液体为水,二氧化碳溶于水,n值偏小,则m值偏大,m与n的比值偏大;
故答案为:3:2;偏大.
III.(1)SO2气体通入CuCl2溶液中,生成CuCl沉淀,发生氧化还原反应,则S元素的化合价升高,则生成H2SO4,由元素守恒可知还生成HCl,
故答案为:H2SO4、HCl;
(2)2CuFeS2+4O2$\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO中,Cu、O元素的化合价降低,得到电子被还原,则被还原的元素为Cu、O;S元素的化合价升高,每转移0.6mol电子,被氧化的S为$\frac{0.6mol}{4-(-2)}$=0.1mol,故答案为:0.1;
(3)Cu元素的化合价由+1价升高为+2价,气体产物为NO和NO2的混合物,且体积比为1﹕1,得到电子数为1×(5-2)+1×(5-4)=4,Cu2O失去电子数为2,由电子守恒及原子守恒可知,反应为2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O,
故答案为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
点评 本题考查物质的制备与组成测定\Cu及其化合物的性质,综合考查元素化合物知识,侧重对实验现象的分析、问题讨论的考查,综合考查学生对知识的迁移应用,难度中等.


科目:高中化学 来源: 题型:解答题

| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
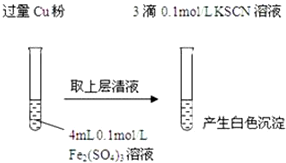
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
| A. | 该装置能将化学能转化为电能 | |
| B. | A极为正极 | |
| C. | B极上发生氧化反应 | |
| D. | 每有1 mol CH3COO-被氧化,就有8 mol电子通过整个电路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L 0.1 mol•L-1的FeSO4溶液中含有0.4NA个氧原子 | |
| B. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L | |
| C. | 1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA | |
| D. | 常温下,pH=7的0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com