
【题目】下列各组物质在溶液中的反应可用H++OH-===H2O表示的是( )
A.氢氧化钡和硫酸
B.氢氧化铁和盐酸
C.醋酸和氢氧化钠
D.硫酸氢钠和氢氧化钠
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。

取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:

②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉学名“连二亚硫酸钠”,但实际上是不“保险”的,属于一级遇湿易燃物品,遇水后可发生剧烈反应:2Na2S2O4+2H2O+O2===4NaHSO3。在该反应中Na2S2O4表现( )
A.氧化性
B.还原性
C.既表现氧化性又表现还原性
D.既不表现氧化性也不表现还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入1或2滴酚酞溶液
⑤滴入一滴标准液后,溶液颜色由无色变为红色立即停止滴定,记录液面读数
请回答:
(1)以上步骤有错误的是(填编号) 。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________中。(从图中选填“甲”或“乙”)

(3)下列操作会引起实验结果偏大的是:_________(填编号)
A.酸式滴定管未润洗
B.滴定前,滴定管尖嘴无气泡,滴定后有气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.滴定结束时仰视滴定管,并记录数据
E.滴定过程中有一滴标准液飞溅出锥形瓶
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视 。
II.利用中和滴定的原理,在工业生产中还可以进行氧化还原滴定测定物质含量。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉状TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(5)除去TiCl4含有的杂质A3+可选用调节pH的方法使其转化为A(OH)3沉淀除去。已知Al(OH)3的![]() ,若想将Al3+完全沉淀(不考虑钛离子的沉淀),则溶液的pH一定不能小于__________。(
,若想将Al3+完全沉淀(不考虑钛离子的沉淀),则溶液的pH一定不能小于__________。(![]() 时,即可认为完全沉淀)
时,即可认为完全沉淀)
(6)TiCl4水解生成TiO2·xH2O的化学方程式为__________________________。
(7)滴定终点的现象是___________________________。
(8)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的含量是空气质量监测的一个重要指标。
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验。
① 测得该雨水样品的pH为4.73;
② 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
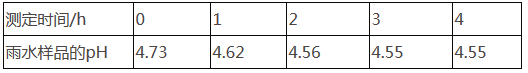
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为___________________。
(2)分析上述数据变化,你认为形成这一变化的原因是__________________。
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是_____________。
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是
A. SiH4的沸点高于CH4,可推测PH3 的沸点也高于NH3
B. CO2 晶体是分子晶体,可推测SiO2 晶体也是分子晶体
C. PCl3 为三角锥形,可推测NF3 也为三角锥形结构
D. C2H6的碳链是直线形的,可推测C3H8 的碳链也是直线形的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是
A. 乙酸乙酯和水,酒精和水,植物油和水 B. 四氯化碳和水,溴苯和苯,硝基苯和水
C. 甘油和水,乙酸和水,乙酸和乙醇 D. 汽油和水,苯和水,已烷和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:
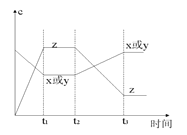
从t2→t3的曲线变化是由哪种条件引起的( )
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com