
| A. | H-H键无方向性 | |
| B. | 基态C原子有两个未成对电子,所以最多只能形成2个共价键 | |
| C. | 1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性所决定的 | |
| D. | 气体单质中,一定有σ键,可能有π键 |
分析 A.H的1s电子为球形对称;
B.基态C原子有两个未成对电子,但可杂化形成4个等同的sp3杂化轨道;
C.N最外层有5个电子,未成对电子数为3;
D.单原子分子中没有共价键.
解答 解:A.H的1s电子为球形对称,s-s电子重叠没有方向性,则H-H键无方向性,故A正确;
B.基态C原子有两个未成对电子,但可杂化形成4个等同的sp3杂化轨道,可形成4个共价键,故B错误;
C.N最外层有5个电子,未成对电子数为3,则1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的,故C正确;
D.单原子分子中没有共价键,如He,不存在σ键和π键,故D错误;
故选AC.
点评 本题考查共价键的形成及性质等,把握共价键的形成及电子云的重叠等为解答的关键,侧重分子结构与性质的考查,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定完全相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子如果核外电子排布相同,则一定具有相同的中子数 | |
| D. | 某离子M层和L层上的电子均为K层的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 热稳定性:HF>HI>HBr>HCl | |
| D. | 熔点由高到低:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
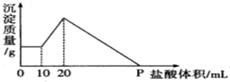 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 合成氨是放热反应,采用在较高温度下进行反应 | |
| D. | 实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com