
【题目】可逆反应:2NO2![]() 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;
②单位时间内生成n molO2的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体中![]() 不变;
不变;
⑤混合气体的颜色不再改变的状态;
⑥混合气体的密度不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态.
A. ①⑤⑥ B. ①④⑤⑦ C. ①⑤⑥⑦ D. ①③⑤⑥⑦
【答案】B
【解析】试题分析:①根据单位时间内生成nmolO2的同时生成2nmol NO2 ,可知生成氧气的速率和消耗速率相等,达到了平衡状态,故①正确;②单位时间内生成nmolO2的同时生成2nmol NO,都是正反应速率,无法判断是否达到平衡,故②错误;③任何情况下,同一反应方向、同一时间段内用NO2、NO、O2的物质的量浓度变化表示的反应速率的比均为2:2:1,如果不是同一反应方向,只有达到平衡中同时才符合该比值,故③错误;④混合气体中![]() 不变,说明各物质的含量不再变化,反应已达到平衡状态,故④正确;⑤混合气体颜色不再改变,说明生成的二氧化氮和消耗的速率相等,反应达到了平衡状态,故⑤正确;⑥反应前后混合气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能判断反应达到平衡状态,故⑥错误;⑦反应物和生成物都是气体,反应前后气体质量不变,物质的量不同,平均相对分子质量不再改变,说明反应达到平衡状态,故⑦正确。综上所述,选项B正确。
不变,说明各物质的含量不再变化,反应已达到平衡状态,故④正确;⑤混合气体颜色不再改变,说明生成的二氧化氮和消耗的速率相等,反应达到了平衡状态,故⑤正确;⑥反应前后混合气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能判断反应达到平衡状态,故⑥错误;⑦反应物和生成物都是气体,反应前后气体质量不变,物质的量不同,平均相对分子质量不再改变,说明反应达到平衡状态,故⑦正确。综上所述,选项B正确。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②![]() 、
、![]() 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)![]() 、
、![]() 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)写出B单质与A元素的最高价氧化物对应水化物的溶液反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯: 可简化为
可简化为![]() 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为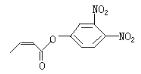 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.均能发生银镜反应 B.遇FeCl3溶液均显紫色
C.均能与NaHCO3溶液发生反应 D.均能与浓溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~H 8种元素在周期表中的位置:

(1)8 种元素中化学性质最不活泼的是_________(填元素符号);
(2)元素E、F的最高价氧化物对应的水化物反应的离子方程式为______________;
(3)元素D的最低价的氢化物与单质G发生反应的化学方程式为_______________;
(4)写出元素A、C形成的化学式为CA5的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷的用途很广泛。
(1)已知:
2NO2(g )![]() N2O4(g) △H= -56.9kJ·mol -1
N2O4(g) △H= -56.9kJ·mol -1
H2 O(g)= H2O(l) △H= -44.0kJ·mol -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H=-898.1kJ·mol -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为_____________________。
(2)一定条件下,发生2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
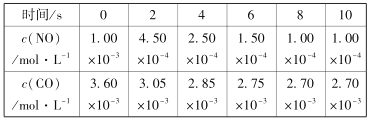
①该温度下,该反应的平衡常数表达式为K =_____________________;
②计算前4秒内氮气的平均反应速率为____________________;
③下列选项中,不能说明上述反应已达平衡的是( )
A.2v正(NO)= v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示
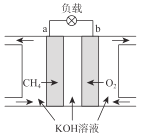
①该燃料电池的正极为_______________(填“a”或“b”)。该电池负极的电极反应式为_____________;
②放电一段时间后,电解质溶液的pH___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷灰石(一类含钙的磷酸盐矿物总称)原料生产磷铵的工艺流程图如下:
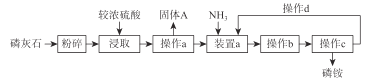
已知:纯的磷酸铵盐为白色晶体,其中以磷酸一铵最稳定,磷酸二铵次之,磷酸三铵不稳定,不宜作肥料使用。
(1)用硫酸浸取磷灰石,利用了硫酸的__________等性质。
(2)操作 a 的名称是__________;装置a中要控制“N/P”,使反应能生成较多的一种酸式盐,其化学式为__________。
(3)固体 A 的化学式为__________,其用途有__________。
(4)操作b为__________、__________。
(5)磷铵属于________。 (填写“单一”或“复合”)
(6)操作C为过滤、洗涤、干燥,在洗涤过程中可选用下列试剂进行洗涤________ (选填字母),其优点是________。
(7)本工艺流程中操作 d 的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
c | d | e | |||||||||||||||
f | g | ||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
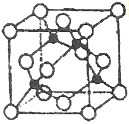
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)为原料生产CuCl的流程如下:
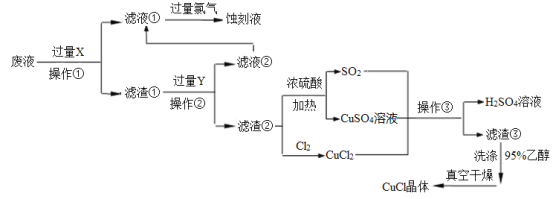
已知:CuCl是一种白色粉末,微溶于水,不溶于乙醇及稀硫酸,在水溶液中存在平衡:
CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
[CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
根据以上信息回答下列问题:
(1)试剂X是______,检验刻蚀液中金属阳离子的化学试剂是_____。(均填化学式)
(2)操作①、②、③相同,名称是________,所需要的主要玻璃仪器有烧杯、___ 、_____。
(3)滤渣①与Y反应的离子方程式为_________________。
(4)产生CuCl的化学方程式为_______________,当观察到 现象,即表明反应已经完全。
(5)在操作③之前往往向反应后的溶液中加入大量的水,其作用是 。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com