
������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��
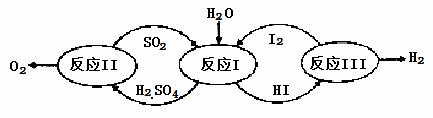
��1����Ӧ��Ļ�ѧ����ʽ�� ��
��2����Ӧ��õ��IJ�����I2���з��롣�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㡪������Ũ��I2��H2SO4���Ũ�ȵ�I2��HI�㡣
�ٸ���������ʵ������˵����ȷ���� ��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ����� ��
�۾���⣬H2SO4����c(H+)��c(SO42-)=2.06��1�����ֵ����2��ԭ���� ��
��3����Ӧ��2H2SO4��l��=2SO2(g)+O2(g)+2H2O(g) ��H=+550kJ/mol
����������Ӧ��ɣ�i��H2SO4��l��=SO3(g) +H2O(g) ��H=+177kJ/mol
ii��SO3(g)�ֽ⡣
L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ��ii��SO3(g)��ƽ��ת������X�ı仯��ϵ��
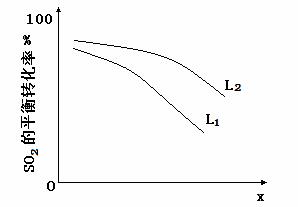
��X�������������� ��
���ж�L1��L2�Ĵ�С��ϵ�����������ɣ� ��
���𰸡�
��1��SO2 + 2H2O + I2 = H2SO4 + 2HI
��2����a��c
�ڹ۲���ɫ����ɫ�����HI�㣬��ɫdz���������
��������������HI
��3����ѹǿ ��L2>L1 2SO3��g��= 2SO2��g��+O2��g����H=+196kJ/mol,ѹǿһ��ʱ���¶����ߣ�ƽ��ת��������
 �����㶨λ�����鷽��ʽ��ƽ;���Ӽ���;ƽ��ͼ�����;��ѧƽ��Ӱ������
�����㶨λ�����鷽��ʽ��ƽ;���Ӽ���;ƽ��ͼ�����;��ѧƽ��Ӱ������
����ʦ���硿������ͨ��̫�����Ʊ�����ԴΪ�زĿ��黯ѧ����ʽ����д��Ԫ�ػ�����֪ʶ����ѧƽ�����ۣ��ϺõĿ�����ѧ�����������ѧ֪ʶ�������⡢�������������������˻�ѧ��ѧ���ص㡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������A(C8H8O3)Ϊ��ɫҺ�壬������ˮ����������ζ����A�������ɷ���ͼʾ��һϵ�з�Ӧ��ͼ�еĻ�����A������ȡ��ʱ����������һȡ���������D��ʹFeCl3��Һ����ɫ��G�ܽ���������Ӧ��E��H������Ϊ���塣�Իش�
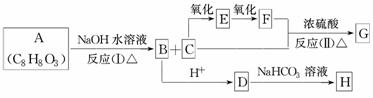
(1)д�����л�����Ľṹ��ʽ��
A��________��B��________��G��________��
(2)C�еĹ���������Ϊ________��
(3)��Ӧ���ͣ�(��)________��(��)________��
(4)д��D��H�Ļ�ѧ����ʽ��____________________________________________
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
40��ʱ���ڰ���ˮ��ϵ�в���ͨ��CO2���������ӵı仯��������ͼ��ʾ������˵������ȷ���ǣ� ��
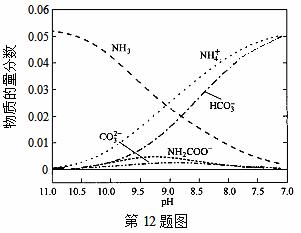
A����pH��9.0ʱ��c(NH4+)��c(HCO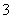 )��c(NH2COO��)��c(CO32��)
)��c(NH2COO��)��c(CO32��)
B����ͬpH����Һ�д��ڹ�ϵ��c(NH4+)��c(H+)��2c(CO32��)��c(HCO3��)��c(NH2COO��)��c(OH��)
C������CO2��ͨ�룬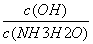 ��������
��������
D������Һ��pH���Ͻ��͵Ĺ����У��к�NH2COO�����м��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����п�̸ɵ����һ��һ�ε�أ����Ϊ����п���м���̼��������Χ��̼�ۣ�MnO2��ZnCl2��NH4Cl����ɵĺ�״�����õ���ڷŵ���̲���MnOOH�����մ����÷ϵ�ؿɵõ����ֻ���ԭ�ϣ��й������±���ʾ��
�ܽ��/(g/100gˮ)
|
������ | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| ������ | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp����ֵ | 10-17 | 10-17 | 10-39 |
�ش��������⣺
��1���õ�ص�������ӦʽΪ ����ط�Ӧ�����ӷ���ʽΪ��
��2��ά�ֵ���ǿ��Ϊ0.5A����ع�������ӣ�����������Zn g�����Ѿ�F��96500C/mol��
��3���ϵ�غ�״������ˮ�������ˣ���Һ����Ҫ��ZnCl2��NH4Cl�����߿�ͨ��____������գ���������Ҫ�ɷ���MnO2��______�� �������еõ��ϴ���MnO2������ķ����� ����ԭ���� ��
��4���÷ϵ�ص�пƤ�Ʊ�ZnSO4��7H2O�Ĺ����У���ȥ���������������䷽���ǣ���ϡ�����H2O2�ܽ⣬����Ϊ_____���Ӽ������pHΪ ʱ�����պ���ȫ����������Ũ��С��1��10-5mol/Lʱ��������Ϊ�����ӳ�����ȫ���������Ӽ������pHΪ_____ʱ��п��ʼ�������ٶ�Zn2��Ũ��Ϊ0.1mol/L�������������̲���H2O2����� ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
10mlŨ��Ϊ1mol/L�������������п�۷�Ӧ��������������������Һ���ܼ�����Ӧ���ʵ��ֲ�Ӱ���������ɵ��ǣ� ��
A��K2SO4 B��CH3COONa C��CuSO4 D��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
FeCl3 ���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeC l3 ��Ч���Ҹ�ʴ��С����ش��������⣺
l3 ��Ч���Ҹ�ʴ��С����ش��������⣺
��1��FeCl3 ��ˮ��ԭ���� ��FeCl3 ��Һ��ʴ�����豸����H�������⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ�� ��
��2��Ϊ��Լ�ɱ�����ҵ����NaClO3 ��������FeCl2 ��Һ�õ�FeCl3 ��
��������FeCl2 ��Һ��c(Fe2��)=2.0��10-2mol��L-1, c(Fe3��)=1.0��10-3mol��L-1, c(Cl��)=5.3��10-2mol��L-1,�����Һ��PHԼΪ ��
�����NaClO3 ����FeCl2 �����ӷ���ʽ��
| |
 ClO3-+
ClO3-+
|
 Fe2��+
Fe2��+ | |
 =
= | |
 Cl��+
Cl��+ | |
 Fe3��+
Fe3��+ | |

 .
. ��3��FeCl3 ����Һ�з�����ˮ�⣺
Fe3��+H2O  Fe(OH)2++H�� K1
Fe(OH)2++H�� K1
Fe(OH)2++H2O Fe(OH)2++H�� K2
Fe(OH)2++H�� K2
Fe(OH)++H2O Fe(OH)3+H�� K3
Fe(OH)3+H�� K3
����ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳���� ��
ͨ����������������ˮ�����ۺϣ����ɾۺ������������ӷ���ʽΪ��
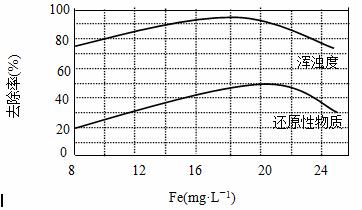 xFe3++yH2O
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
��ʹƽ�������ƶ��ɲ��õķ����ǣ�����ţ� ��
a������ b����ˮϡ��
c������NH4Cl d������NaHCO3
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ������� ��
��4�����ij��ˮ���������Ȼ���������ˮ�Ľ������ͼ��ʾ����ͼ�����ݵó�ÿ����ˮ��Ͷ�žۺ��Ȼ���[��Fe(mg��L-1)��ʾ]����ѷ�ΧԼΪ mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.01mol�������ʷֱ�� ��100mL����ˮ�У��ָ������£�������Һ��������Ũ�ȵĴ�С˳���ǣ���Һ����仯���Բ��ƣ�
��100mL����ˮ�У��ָ������£�������Һ��������Ũ�ȵĴ�С˳���ǣ���Һ����仯���Բ��ƣ�
��Na2O2��Na2O��Na2CO3��NaCl����
| A�� | �٣��ڣ��ۣ��� | B�� | �٣��ڣ��ܣ��� | C�� | ��=�ڣ��ۣ��� | D�� | ��=�ڣ���=�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
С�մ�NaHCO3�������к���̼���ƾ��壨Na2CO3•10H2O����Ϊ�ⶨ������С�մ����������w��NaHCO3����ʵ��С��ͬѧ���������װ�ý���ʵ�飮
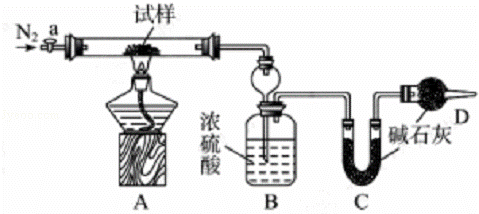
ʵ����̣�
��ͼ��װ���������װ�õ������ԣ�
������m1g����Ӳ�ʲ������У�װ��B��C��D��ҩƷ��ͼ����֪��ҩƷ��װ��B������Ϊm2g��װ��C������Ϊm3g��
�رջ���a����ȼ�ƾ��Ƽ���������ֱ��Bװ����������ð������a��װ����ͨ��N2��һ��ʱ������ƾ��ƣ��رջ���a��
�����Ƶ�װ��B������Ϊm4g��װ��C������Ϊm5g��
��ش��������⣨װ����ԭ�п�����ʵ���Ӱ����Բ��ƣ���
��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ����
��2��װ��B������Ϊ��װ��C������Ϊ��
��3��ʵ�������ͨ��N2��Ŀ�� Ϊ��
��
��4�������и������ṩ�������ܼ����w��NaHCO3������bce����ѡ����ĸ��
| ��� | a | b | c | d | e |
| ���� | m1��m2��m3 | m2��m3��m4��m5 | m1��m2��m4 | m1��m4��m5 | m1��m3��m5 |
��5��ʵ���������װ��A��Ӳ�ʲ������Ҷ���ˮ�飬����Ϊ����ʵ�������ṩ�����ݻ��ܷ�õ�ȷ��w��NaHCO3�������ܣ���w��NaHCO3���ļ���ʽΪ����100%�������ܣ����ʲ����𣮣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����(����)
A��������ﶼ������ͬ�Ĺ�����
B�������������γ�ˮ����ζ����Ҫ�ɷ�
C����֬��������Ӧ����֬����ͱ���
D�������ʵ�ˮ����ﶼ�����Ȼ����ǻ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com