
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
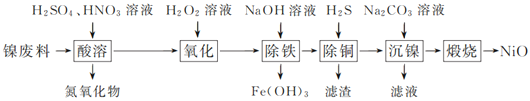
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为___________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________。
【答案】温度低于70 ℃,反应速率降低,温度高于80 ℃,HNO3分解(或挥发)加快 2Fe2++H2O2+2H+=2Fe3++2H2O 3.2≤pH<4.2 CuS xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
(x+y)NiO+xCO2↑+yH2O Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大
【解析】
以镍废料(主要成分为镍铁合金,含少量铜)为原料,加入硫酸、硝酸酸浸,Ni转化为NiSO4,同时生成亚铁离子、铁离子、铜离子等,加入过氧化氢,可氧化亚铁离子生成铁离子,加入氢氧化钠调节pH可生成氢氧化铁沉淀,然后通入硫化氢生成CuS沉淀,达到除铜的目的,在滤液中加入碳酸钠溶液可生成xNiCO3yNi(OH)2,煅烧可生成NiO,以此解答该题。
(1)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃,原因是温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快,故答案为:温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快;
(2)“氧化”时,Fe2+参加反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)“除铁”时,应使铁完全沉淀,且避免生成氢氧化铜,由表中数据可知,需控制溶液的pH范围为3.2≤pH<4.2,故答案为:3.2≤pH<4.2;
(4)由以上分析可知通入硫化氢生成CuS沉淀,故答案为:CuS;
(5)①在隔绝空气条件下,“煅烧”xNiCO3yNi(OH)2得到NiO,该反应的化学方程式为xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O,故答案为:xNiCO3·yNi(OH)2
(x+y)NiO+xCO2↑+yH2O,故答案为:xNiCO3·yNi(OH)2![]() (x+y)NiO+xCO2↑+yH2O;
(x+y)NiO+xCO2↑+yH2O;
②“沉镍”时,溶液pH增大,可生成Ni(OH)2,导致碱式碳酸镍中Ni(OH)2比例增大,而Ni(OH)2中Ni含量高于NiCO3,则碱式碳酸镍中Ni元素含量会增加,故答案为:Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
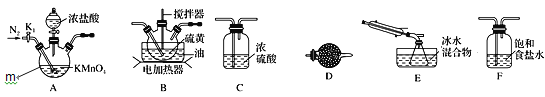
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
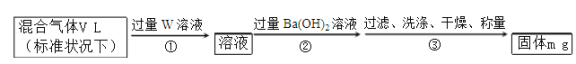
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
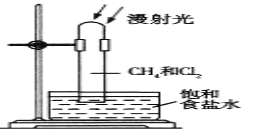
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空。
(1)25℃时,已知 0.1mol·L-1 CH3COOH 溶液的 pH=3,其电离度为__,由水电离的c(H+)=__。
(2)相同 pH的 CH3COOH溶液和 HCl溶液加水稀释,其 pH变化情况如曲线I、II所示,其中表示 HCl溶液的是曲线__,a、b两点中,导电能力更强的是__。
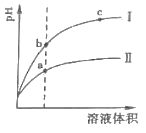
(3)氨水和盐酸等浓度等体积混合后,溶液呈酸性的原因是(用离子方程式表示)__。此时,该混合溶液中离子浓度由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:
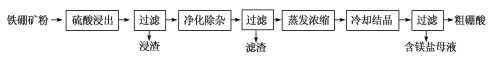
①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,
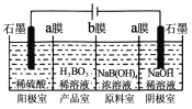
(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3-二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:
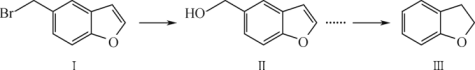
下列叙述正确的是
A. 物质Ⅲ的核磁共振氢谱图显示有四种不同环境的氢
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是___(填字母)。
(2)下列操作合理的是___(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用240 mL容量瓶配制240mL 1 mol·L-1的氢氧化钠溶液
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为___mL。

(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.05 | 26.05 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.36 | 26.31 | 25.95 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度:c(NaOH)=___mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___(填字母)。
A.滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.锥形瓶用待测碱液润洗
D.滴定时酸式滴定管中盐酸洒落在锥形瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L酒精中含有分子的数目为0.5NA
B.常温常压下,3.2g18O2的中子数目为2NA
C.常温常压下,24g镁与足量盐酸充分反应,转移的电子数为2NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com