
氯化钯是一种重要的催化剂,在石油化工和汽车尾气转化中应用广泛,从工业废料中提取钯通常得到的物料是二氯二氨合钯,然后再用复杂的工艺得到氯化钯,并且环境污染严重,转化率低。2005年有人报道制取的新工艺,过程较简单,无污染,直收率99%,产品纯度>99.95%。
⑴ 在二氯二氨合钯中加入一定量的水和盐酸,加热至100℃得澄清溶液A。写出该反应的化学方程式:
⑵ 于上述A的热溶液中加入一定量的氯酸钠溶液,继续加热溶液有气体逸出,得溶液B,写出该反应的化学方程式,此时钯以何形式存在?
⑶ 在溶液B中加入10% NaOH溶液调节pH=10,保持溶液温度在100℃左右得沉淀C。如溶液PH>10,上清液中钯含量升高。分别写出溶液B中生成沉淀C及上清液中钯量又升高的化学反应方程式。
⑷ 在C中加入浓盐酸加热至100℃浓缩直至蒸干,再在120℃下烘5小时。写出发生的化学反应方程式。
⑴ Pd(NH3)2Cl2+2HCl=(NH4)2[PdCl4](2分)
⑵ 6ClO3-+10NH4+=3Cl2+5N2+18H2O+4H+(2分)
钯以H2PdCl4形式存在(1分)
⑶ H2PdCl4+4NaOH=Pd(OH)2↓+4NaCl+2H2O(2分)
过量NaOH与部分Pd(OH)2发生反应:Pd(OH)2+2NaOH=Na2[Pd(OH)4](2分)
⑷ Pd(OH)2+2HCl=PtCl2+2H2O(1分)
⑴二氯二氨合钯(Ⅱ)与HCl发生配体的取代反应,生成配阴离子PtCl42-,阳离子为NH4+。因此A为(NH4)2[PdCl4],反应方程式为Pd(NH3)2Cl2+2HCl=(NH4)2[PdCl4]。
⑵氯酸钠的主要作用在于氧化NH4+生成N2,同时ClO3-被还原生成Cl2。利用离子-电子法配平该氧化还原方程式:
氧化反应:2NH4+-6e-→N2+8H+
还原反应:2ClO3-+12H++10e-→6H2O+Cl2
∴化学反应方程式为:6ClO3-+10NH4+=3Cl2+5N2+18H2O+4H+
由于溶液酸性增强,所以钯此时以H2PdCl4形式存在。
⑶根据题意,沉淀为Pd(OH)2。当溶液碱性增强时,OH-作为配体,进一步与Pd(Ⅱ)配位,形成四配位的Pd(OH)42-,从而导致上层清液中钯含量升高。
⑷Pd(OH)2与盐酸发生中和反应,生成产物PdCl2。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第6讲 化学反应速率和化学平衡练习卷(解析版) 题型:选择题
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 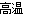 4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
A.增大反应体系的压强,反应速率可能加快
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期第三次验收考试化学试卷(解析版) 题型:实验题
无水氯化铝是一种重要的有机合成催化剂,还可用于金属冶炼、润滑油合成;食品级无水氯化铝也可用作膨松剂、絮凝剂等。
某研究性学习小组查阅资料后利用下图所示装置制备无水氯化铝。
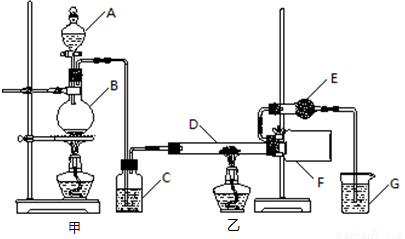
资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃升华,其蒸气是缔合分子(Al2Cl6),在空气中能吸收水分,发生水解。
(1)填写下列仪器的名称:A ,B 。
(2)装置C中盛装的试剂是 ;装置G中盛装的试剂是 。
(3)相同条件下,氯化铝蒸气对氢气的相对密度是 。
(4)装置F中的现象是 。
(5)装置E的作用是 。
(6)实验结束后应先撤去 (填“甲”或“乙”)处的酒精灯。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)氯化钯是一种重要的催化剂,在石油化工和汽车尾气转化中应用广泛,从工业废料中提取钯通常得到的物料是二氯二氨合钯,然后再用复杂的工艺得到氯化钯,并且环境污染严重,转化率低。2005年有人报道制取的新工艺,过程较简单,无污染,直收率99%,产品纯度>99.95%。
8-1 在二氯二氨合钯中加入一定量的水和盐酸,加热至100℃得澄清溶液A。写出该反应的化学方程式:
8-2 于上述A的热溶液中加入一定量的氯酸钠溶液,继续加热溶液有气体逸出,得溶液B,写出该反应的化学方程式,此时钯以何形式存在?
8-3在溶液B中加入10%NaOH溶液调节pH=10,保持溶液温度在100℃左右得沉淀C。如溶液pH>10,上清液中钯含量升高。分别写出溶液B中生成沉淀C及上清液中钯含量又升高的化学反应方程式。
8-4在C中加入浓盐酸加热至100℃浓缩直至蒸干,再在120℃下烘5小时。写出发生的化学反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com