
【题目】请认真审题并作答:
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_______________________。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2,由此可以推知CN22-的空间构型为__________________。
(2)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。
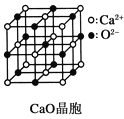
(4)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ·mol-1、NaCl 786kJ·mol-1。导致两者晶格能差异的主要原因是________________。
【答案】 1s22s22p63s23p63d104s2或[Ar]3d104s2 直线形 分子间氢键 6 CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量
【解析】(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形,故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;直线形;
(2)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.故答案为:分子间氢键;
(3)以钙离子为中心,沿X、Y、Z三轴进行切割,上下左右前后,结合图片知,钙离子的配位数是6,故答案为:6;
(4)晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,故答案为:CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=5,此时酸碱恰好中和
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b、c两点水的电离程度:b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述,不正确的是( )
A.氯气是一种有毒的气体 B.氯气、氯水、液氯是同一种物质
C.氯气能与水发生反应 D.氯气是一种黄绿色,有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为___________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_______________。
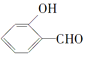 的沸点比
的沸点比![]() 高,原因是______________________。
高,原因是______________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为________________。
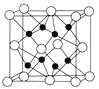
(4)CaF2离子晶体的晶胞结构如图所示。该离子化合物晶胞的边长为a cm,则晶体的密度是_____________g/cm3(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组说法一定正确的是( )
A.强电解质:盐酸、氢氧化钡、明矾
B.纯净物:冰水混合物;含氧40%的氧化镁
C.有单质参加和单质生成的化学反应一定是氧化还原反应
D.同位素:H2、D2、T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某透明的溶液中,能大量共存的离子组是
A.Na+、AlO2-、SO42-、H+ B.K+、Al3+、OH-、NO3-
C.H+、Fe2+、Cl-、MnO4- D.Na+、CO32-、SO42-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数为3:2
B. 1L CO的质量一定比1L O2的质量小
C. 标准状况下,将3.36 L Cl2通入1 L0.2 mol/L FeBr2溶液中,被氧化的Br数目为0.1NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com