
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O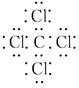
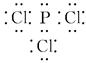 , 均满足8电子
, 均满足8电子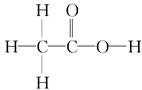 ,C原子的杂化类型分别为sp3和sp2。O和N元素比较,
,C原子的杂化类型分别为sp3和sp2。O和N元素比较,

科目:高中化学 来源:不详 题型:单选题
| A.非金属元素的原子最外层电子数都大于或等于4 |
| B.只有非金属能形成含氧酸或含氧酸盐 |
| C.非金属元素组成的化合物不一定是共价化合物 |
| D.非金属的最高价含氧酸都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SiO3>H2CO3 |
| B.热稳定性:H2Se>H2S>H2O |
| C.碱性:CsOH>Ca(OH)2 |
| D.若离子半径:R2->M+,则原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D.第3周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若R(OH)n为强碱,则W(OH)(n+1)也为强碱 |
| B.若HnXOm为强酸,则Y是活泼非金属元素 |
| C.若Y的最低化合价为-2,则Z的最高正化合价为+6 |
| D.若X的最高正化合价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属阳离子的半径大于它的原子半径 |
| B.金属阳离子的半径小于它的原子半径 |
| C.非金属阴离子的半径与其原子半径相等 |
| D.非金属阴离子的半径小于其原子半径 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com