
| A. | 元素周期表有8个主族 | B. | 0族原子的最外层电子数均为8 | ||
| C. | ⅠA族的元素全是金属元素 | D. | 短周期是指第1、2、3周期 |
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:填空题

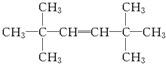 ,D
,D .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(CH3COO-)>c(Na+) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
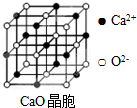 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: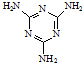 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.11 | B. | 22.22 | C. | 30.00 | D. | 32.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
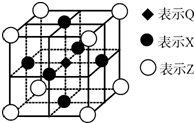 已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H5COOH | B. | C6H13COOH | C. | C7H15COOH | D. | C6H5CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com