
【题目】金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
表1 浸出液成分
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
浓度/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
(1)浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
浸出液在不同pH下萃取的结果如图1。
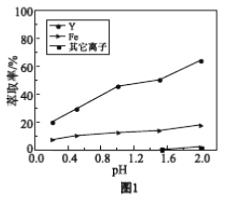
①用化学平衡原理解释,随pH增大,Y3+萃取率增大的原因________。
②结合图1解释,工业上萃取Y3+之前,应首先除去Fe3+的原因是________。
(2)采用“中和沉淀法”和“磷酸法”可以除铁。
表2 Fe3+、Y3+去除率
终点pH | 去除率/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
中和沉淀法:向浸出液中加入NaOH除Fe3+,去除率如表2所示。
①该实验条件下,Fe3+去除率比Y3+大的可能原因________。
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,再加入Na2CO3溶液,调pH为2.5,过滤除去磷酸铁沉淀(FePO4),滤液中剩余的Fe3+、Y3+浓度如表3。
表3 滤液中Fe3+、Y3+的浓度
Fe3+ | Y3+ | |
浓度/(mgL-1) | 508 | 68.9 |
② 配平“磷酸法”除铁过程中的离子方程式
Fe3+ + + = FePO4↓+ CO2↑+ ,___________________
③ 综合分析表1、表2、表3,工业上采用“磷酸法”除铁的原因________。
(3)经“磷酸法”除铁后,用有机溶剂HR萃取Y3+,可通过________(填操作)收集含Y3+的有机溶液。
(4)综合分析以上材料,下列说法合理的是________。
a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的Fe3+多于水溶液中的Fe3+
b. 表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低
【答案】 Y3+在溶液中存在平衡:Y3++3HR![]() YR3+3H+,pH增大,c(H+) 减小(或c(OH-)增大),平衡右移,Y3+萃取率提高 Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大 KSP[Fe(OH) 3]小于KSP[Y(OH) 3]或Fe(OH) 3的溶解度小于Y(OH) 3或c(Fe 3+)远大于c(Y3+) 2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O 磷酸法除铁率较高同时Y3+损失率较小 分液 bcd
YR3+3H+,pH增大,c(H+) 减小(或c(OH-)增大),平衡右移,Y3+萃取率提高 Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大 KSP[Fe(OH) 3]小于KSP[Y(OH) 3]或Fe(OH) 3的溶解度小于Y(OH) 3或c(Fe 3+)远大于c(Y3+) 2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O 磷酸法除铁率较高同时Y3+损失率较小 分液 bcd
【解析】考查化学反应原理的综合运用,(1)①Y3+的溶液中存在:Y3++3HR![]() YR3+3H+,pH增大,c(H+)减小,根据勒夏特列原理,平衡向正反应方向移动,Y3+的转化率增大,即Y3+萃取率提高;②根据Fe3+ + 3HR
YR3+3H+,pH增大,c(H+)减小,根据勒夏特列原理,平衡向正反应方向移动,Y3+的转化率增大,即Y3+萃取率提高;②根据Fe3+ + 3HR ![]() FeR3 + 3H+,Y3+ + 3HR
FeR3 + 3H+,Y3+ + 3HR ![]() YR3 + 3H+ ,Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大,因此萃取Y3+之前,应除去Fe3+,防止对Y3+萃取产生干扰;(2)①表2采用的是中和沉淀法,通过条件pH,Fe3+去除率高,其原因可能是KSO[Fe(OH)3]<Ksp[Y(OH)3],或者Fe(OH)3的溶解度远远小于Y(OH)3溶解度;②根据原理,加入的物质Fe3+、H3PO4、Na2CO3,生成了FePO4和CO2,没有化合价的变化,因此离子反应是Fe3++H3PO4+CO32-→FePO4↓+CO2↑,H3PO4中H转化成H2O,Fe3++H3PO4+CO32-→FePO4↓+CO2↑+H2O,根据电荷守恒和原子守恒进行配平,即2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O;③根据表1、2、3中的数据,得出磷酸法除铁率较高同时Y3+损失率较小;(3)有机溶剂为萃取剂,不溶于水,因此采用分液方法进行分离;(4)a、根据Fe3+ + 3HR
YR3 + 3H+ ,Fe3+和Y3+萃取存在竞争性,Fe3+对Y3+萃取干扰较大,因此萃取Y3+之前,应除去Fe3+,防止对Y3+萃取产生干扰;(2)①表2采用的是中和沉淀法,通过条件pH,Fe3+去除率高,其原因可能是KSO[Fe(OH)3]<Ksp[Y(OH)3],或者Fe(OH)3的溶解度远远小于Y(OH)3溶解度;②根据原理,加入的物质Fe3+、H3PO4、Na2CO3,生成了FePO4和CO2,没有化合价的变化,因此离子反应是Fe3++H3PO4+CO32-→FePO4↓+CO2↑,H3PO4中H转化成H2O,Fe3++H3PO4+CO32-→FePO4↓+CO2↑+H2O,根据电荷守恒和原子守恒进行配平,即2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O;③根据表1、2、3中的数据,得出磷酸法除铁率较高同时Y3+损失率较小;(3)有机溶剂为萃取剂,不溶于水,因此采用分液方法进行分离;(4)a、根据Fe3+ + 3HR ![]() FeR3 + 3H+,pH越大,Fe3+萃取率提高,但有机溶剂中不含有Fe3+而是FeR3,pH在0.2~2.0范围内,有机溶剂中的Fe3+小于水溶液中的Fe3+ ,故a错误;b、表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附,氢氧化铁表面积大,能够吸附微粒,故b正确;c、表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓,故c正确;d、有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低,故d正确。
FeR3 + 3H+,pH越大,Fe3+萃取率提高,但有机溶剂中不含有Fe3+而是FeR3,pH在0.2~2.0范围内,有机溶剂中的Fe3+小于水溶液中的Fe3+ ,故a错误;b、表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附,氢氧化铁表面积大,能够吸附微粒,故b正确;c、表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓,故c正确;d、有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低,故d正确。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】我国是世界文明古国,商周时期就制造出了“四羊方尊”、“ 司母戊鼎”等精美青铜器。青铜的主要成分是Cu,还含有少量第ⅣA族的Sn和Pb。回答下列问题:
(1)基态Cu原子的价电子排布图是___________________,基态Sn原子的未成对电子数是Cu的__________倍,Pb位于周期表的______________区。
(2)向CuSO4溶液中加入过量的氨水再加少许乙醇可以析出美丽的蓝色晶体:[Cu(NH3)4]SO4·H2O。
①SO42-中S的杂化方式是___________,晶体所含非金属中电负性最小是__________________。
②请表示出[Cu(NH3)4]2+离子中的全部配位键____________,1mol[Cu(NH3)4]2+中含有_____molσ键。
③水分子的键角为1050,小于NH3分子键角1070,产生此差异的原因是_______________。
(3)铜晶胞模型如图所示: ,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应 X+Y2Z 影响的示意图.下列叙述正确的是( ) 
A.上述可逆反应的正反应为放热反应
B.X、Y、Z 均为气态
C.X 和 Y 中只有一种是气态,Z 为气态
D.上述反应的正反应的△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 
A.加入Na2SO4可以使溶液由a点变到c点
B.通过蒸发可以使溶液由d点变到c点
C.b、d点都是不能长时间稳定存在的点
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,现象和结论均正确的是
选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a.某有机物A化学式为CxHyOz,15 gA完全燃烧生成22 gCO2和9 gH2O。试确定:
(1)该有机物的最简式______________;
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为 _______________ ;
(3)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为______________;
(4)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为_______。
b.有机物A、B、C、D在一定条件下有如图所示的转化关系:

请回答下列有关问题:
(1)写出B的分子式:____________________。
(2)分别写出反应①的反应方程式______________和②的反应方程式________________________
(3)③的反应类型为___________________________。
(4)两分子D在浓硫酸存在的条件下加热可以发生自身的酯化反应生成E或F,且E的相对分子质量比F的小,则E和F的结构简式分别为___________________、_________________。
(5)下列关于有机物A的说法正确的有__________________(填序号)。
a.含有氢氧根离子,具有碱性
b.能发生加聚反应
c.能使溴水褪色
d.在一定条件下能与冰醋酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置.实验时,先断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( ) 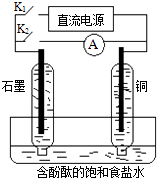
A.断开K2 , 闭合K1时,总反应的离子方程式为:2H++2Cl﹣ ![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2 , 闭合K1时,石墨电极附近溶液变红
C.断开K1 , 闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1 , 闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
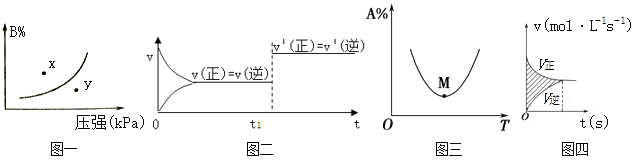
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在选项条件下一定能大量共存的是( )
A.无色溶液:Na+、Cu2+、Cl、NO3-
B.酸性溶液:NH4+、Fe3+、HCO3、SO42-
C.遇酚酞变红的溶液:Na+、K+、SO42-、NO3-
D.碱性溶液:K+、Al3+、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com