
分析 (1)8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收;
(3)a、氧化铝是两性氧化物,能和强酸以及强碱反应,利用氢氧化钠使其变为偏铝酸根即可;
b、步骤②中滤液氧化将亚铁离子氧化成铁离子,生成氢氧化铁、干燥、煅烧得氧化铁;
c、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.
解答 解:(1)8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原,
故答案为:Cu、O;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,
故答案为:bc;
(3)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++Al2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成偏铝酸根,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.步骤②中滤液氧化将亚铁离子氧化成铁离子,生成氢氧化铁、干燥、煅烧得氧化铁,
故答案为:将Fe2+氧化为Fe3+;
c.酸性高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,用硫酸酸化高锰酸钾,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
点评 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.


科目:高中化学 来源: 题型:解答题
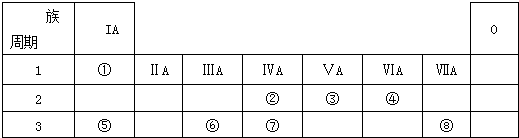
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的分子 | |
| C. | 1molO2中含有1.204×1024个氧原子,在标准状况下占有体积22.4L | |
| D. | 由0.2g H2和8.8g CO2、5.6g CO组成混合气体,其密度是相同状况下O2密度的0.913倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别是能否产生丁达尔现象 | |
| B. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| C. | 江河入海口处易形成三角洲,这与胶体的性质有关 | |
| D. | 胶体的分散质不能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mL pH=10的氨水和100mLpH=4的甲酸溶液导电性相同 | |
| B. | pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 | |
| C. | 稀释pH=10的氨水,溶液中所有离子的浓度均降低 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| C. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| D. | 氯化铁溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
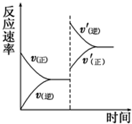 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n>p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量等浓度的NaOH溶液 | B. | 加入适量水 | ||
| C. | 通入适量H2S气体 | D. | 加入适量等浓度的NaHS溶液. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com