
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(每空2分,共12分)(1)N2O4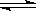 2NO2,吸热
2NO2,吸热
(2)0.14, 0.003 mol/(L·s) (3)0.54 (4)ABD
解析试题分析:(1)N2O4分解生成NO2,反应的化学方程式是N2O4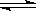 2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
(2)20s时,四氧化二氮的浓度为a
N2O4  2NO2
2NO2
1mol/L 2mol/L
(0.20-a)mol/L 0.12mol/L
解得a=0.14mol/L
则反应的N2O4浓度为(0.2-0.14)mol/L=0.06mol/L
则反应速率v(N2O4)=0.06mol/L÷20s=0.003 mol/(L·s)
(3)平衡时NO2当浓度是0.22mol/L,则N2O4的浓度是0.2mol/L-0.11mol/L=0.09mol/L
所以根据反应的方程式可知,平衡常数K=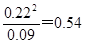
(4)根据化学平衡常数知,K越大,生成物的浓度越大,反应物的浓度越小,N2O4的转化率大、NO2的产量越大、N2O4与NO2的浓度之比越小、正反应进行的程度越大,即选项ABD正确,答案选ABD。
考点:考查化学反应速率、平衡常数的计算、化学平衡常数的应用以及外界条件对平衡状态的影响
点评:该题是高考中的常见题型,属于综合性试题的考查。试题在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知N2O4(无色)?2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
已知N2O4(无色)?2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s n/mol |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com