
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
分析 (1)O3与KI溶液反应生成O2、I2及KOH;
(2)①pH增大,则OH-浓度增大,O3分解速率加快;
②根据v=$\frac{△c}{t}$计算;
③根据pH和温度判断达到平衡所用的时间的范围,可判断分解速率;
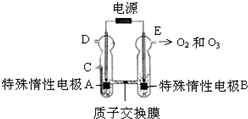
(3))①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②C处通入O2,O2发生还原反应,在酸性条件下生成水.
解答 解:(1)O3与KI溶液反应生成O2、I2及KOH,所以反应方程为,O3+2I-+H2O=O2+I2+2OH-,所以两种单质是I2、O2,
故答案为:I2、O2;
(2)①pH增大,则OH-浓度增大,pH增大能加速O3分解,表明对O3分解起催化作用的是OH-,
故答案为:OH-;
②v=$\frac{△c}{△t}$=$\frac{0.0108mol/L}{108min}$=1.00×10-4mol/(L•min),
故答案为:1.00×10-4;
③由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231nin;
30°C、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c,
故答案为:b、a、c;
(3)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑;
故答案为:A;2H++2e-═H2↑;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O.
点评 本题考查化学反应速率的影响因素的实验探究,原电池与电解池反应原理,题目难度中等,本题注意对表中数据的分析和处理.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH 溶液:H+、A13+、Al(OH)3 | |
| B. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含有等物质的量的MgCl2、NH4Cl的溶液中加入NaOH溶液:NH4Cl、MgCl2 | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 3.2 g O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol/L的Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
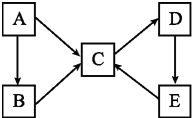 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl熔点、沸点 | 比较F和Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H2CO3、H2SO3两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 | 比较氨水和氢氧化铝的碱性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com