
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30 mL 1.0 mol·L1 H3PO4和 3 mL 30% H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30 mL 1.0 mol·L1H3PO4和3 mL H2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85% H3PO4配制100 mL 1.0 mol·L1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。
①实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO4溶液后,立即测定pH,pH迅速降低。
②形成氧化膜(以Fe2O3计)的离子方程式是______。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。
【答案】100mL容量瓶 ![]() 未排除氧气的干扰 取与实验I初始时pH和浓度均相同的H2O2溶液于试管中
未排除氧气的干扰 取与实验I初始时pH和浓度均相同的H2O2溶液于试管中 ![]() 铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气
铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气
【解析】
题目是进行探究性实验,在实验I中,铁钉表面产生气泡,是因为铁与H3PO4反应生成氢气,因为溶液保持澄清,根据信息可知还生成了Fe(H2PO4)2,一段时间后再产生大量气泡,再停止,出现周而往复的现象,与实验II对比可知是H2O2发生了作用,再根据后续的探究性实验分析出现周而往复的现象的原因。
(1)根据配制一定物质的量的溶液所需要的仪器,还缺少100mL容量瓶,故答案为:100mL容量瓶;
(2)由题目信息可知,铁与H3PO4反应生成氢气和Fe(H2PO4)2,化学方程式为:![]() ;
;
(3)氧气在酸性条件下可以将亚铁离子氧化成成铁离子,故实验Ⅲ无法证实假设成立,故答案为:未排除氧气的干扰;
(4)①、实验Ⅳ要证实形成氧化膜过程中产生H+,根据控制变量的思想,操作为:取与实验I初始时pH和浓度均相同的H2O2溶液于试管中,滴入少量FeSO4溶液后,立即测定pH,pH迅速降低;故答案为:取与实验I初始时pH和浓度均相同的H2O2溶液于试管中;
②、亚铁离子被H2O2溶液氧化为Fe2O3,离子方程式为:![]() ;
;
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析如下:铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气。
故答案为:铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是______
A.H2SO4 B.HCl C.HNO3
(2)除去滤液1中Cu2+的离子方程式是___________________________
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中![]() <0.7时,滤液1中能够检验出有Fe2+;
<0.7时,滤液1中能够检验出有Fe2+;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
①检验Fe2+是否氧化完全的实验试剂是__________ A.KSCN B.K3Fe(CN)6
②若![]() >1,调节
>1,调节![]() 到0.7~1的最理想试剂是_______(填序号)
到0.7~1的最理想试剂是_______(填序号)
a.NaOH溶液 b.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在平衡Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
A.H2SB.NaHCO3C.盐酸D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
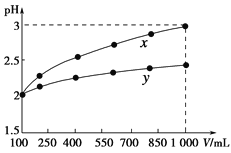
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
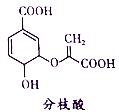
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com