
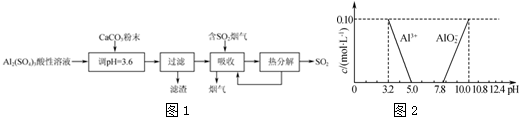
分析 根据流程可知,Al2(SO4)3溶液中加入CaCO3调节溶液的pH至3.6,使Al2(SO4)3转化为CaSO4沉淀,过滤得滤渣为CaSO4,滤液中含有铝离子、硫酸根离子等,吸收含有二氧化硫的烟气,在溶液中生成亚硫酸根离子,部分亚硫根离子会被空气氧化成硫酸,将溶液再加热亚硫酸盐分解生成二氧化硫,所得溶液循环利用再用来吸收烟气,
(1)过滤时所用的玻璃仪器有漏斗、玻璃棒、烧杯;硫酸根离子与钙离子反应生成硫酸钙是微溶于水的物质,易形成沉淀;
(2)在溶液中SO32-易被氧化生成SO42-,弱酸根离子转化为强酸根离子溶液酸性增强;
(3)根据化合物中化合价代数和为零可知abc的关系;
(4)碱式硫酸铝样品在空气中灼烧至恒重,样品中的氢元素全部以水的形式失去,根据水的质量可求得样品中氢氧根离子的物质的量,在硫酸铝溶液中,随着pH值的升高,调节溶液的pH到5.0~7.8,生成氢氧化铝沉淀,氢氧化铝沉淀经过过滤、洗涤、灼烧至恒重,得氧化铝,根据氧化铝的质量可求得样品中铝元素的物质的量,根据电荷守恒可求得硫酸根离子的物质的量,据此确定品中Al3+和SO42-的物质的量之比.
解答 解:根据流程可知,Al2(SO4)3溶液中加入CaCO3调节溶液的pH至3.6,使Al2(SO4)3转化为CaSO4沉淀,过滤得滤渣为CaSO4,滤液中含有铝离子、硫酸根离子等,吸收含有二氧化硫的烟气,在溶液中生成亚硫酸根离子,部分亚硫根离子会被空气氧化成硫酸,将溶液再加热亚硫酸盐分解生成二氧化硫,所得溶液循环利用再用来吸收烟气,
(1)过滤时所用的玻璃仪器有漏斗、玻璃棒、烧杯,通过以上分析知,滤渣的成分是CaSO4,
故答案为:漏斗、玻璃棒;CaSO4;
(2)溶液吸收二氧化硫生成SO32-,在溶液中SO32-易被氧化生成SO42-,所以上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量;溶液中SO32-属于弱酸根离子被氧气氧化为转化为SO42-,SO42-为强酸根离子,则溶液酸性增强,pH减小;
故答案为:溶液中的部分SO32- 被氧化成SO42-;减小;
(3)根据化合物中化合价代数和为零可知abc的关系为3a=2b+c,
故答案为:3a=2b+c;
(4)由步骤①可知n(H2O)=0.36 g/18 g•mol-1=0.02 mol,所以n(OH-)=0.02 mol×2=0.04 mol,
由③可知1.02 g为Al2O3,则n(Al2O3)=1.02 g/102 g•mol-1=0.01 mol,所以样品中n(Al3+)=0.02 mol 根据电荷守恒可知,样品中n(SO42-)=(0.02 mol×3-0.04 mol)/2=0.01 mol,所以n(Al3+):n(SO42-)=0.02 mol:0.01mol=2:1,
答:样品中Al3+和SO42-的物质的量之比为2:1.
点评 本题考查了物质的制备原理及化学计算,明确物质的性质及各物质的关系是解本题关键,会从整体上分析每一步发生的反应及基本操作,知道加入物质的用途,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | 分子式为C4H8O2且官能团与X相同的物质共有5种 | |
| D. | X完全燃烧后生成CO2和H20的物质的量比为1:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法不正确的是( )
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法不正确的是( )| A. | a点对应的Ksp等于c点对应的Ksp | B. | 加入Na2SO4溶液可以使a点变为b点 | ||
| C. | a点变为b点将有沉淀生成 | D. | d点未达到沉淀溶解平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O,酯化反应或取代反应.
CH3COOCH2CH3+H2O,酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com