
| A. | Fe2+、Na+、NO3-、Cl- | B. | Mg2+、NH4+、SO42-、NO3- | ||
| C. | H+、K+、Cl-、CH3COO- | D. | K+、Mg2+、CO32-、OH- |
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2═CHCH3) | ||
| C. | 石墨和C60 | D. | CH3CHCH3CH3和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
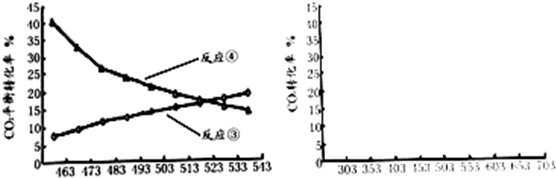
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)2 | B. | A l(OH)3 | C. | Fe(OH)3 | D. | Al(OH)3 和Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里气体的密度为40g•L-1 | |
| B. | SO3的分解率为20% | |
| C. | 化学反应速率v(Ag2SO4)=v(SO3) | |
| D. | 在这10min内的平均反应速率为v(O2)=0.005mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
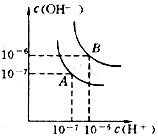 水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com