
| A.用过量的铁与稀硫酸反应制绿矾(FeSO4·7H2O) |
| B.铜与浓硫酸反应制CuSO4 |
| C.过量的Fe与Cl2反应制FeCl2 |
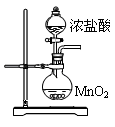
| D.MnO2与稀盐酸反应制Cl2 |
科目:高中化学 来源:不详 题型:问答题
 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下: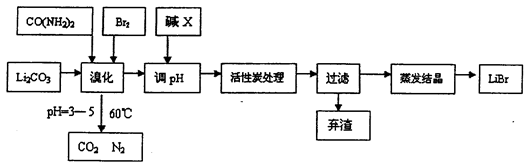
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
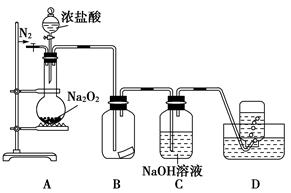
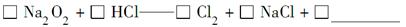
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
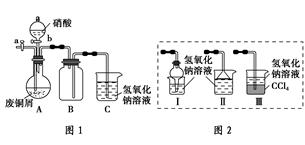
 ________Cu+________CO2↑+________H2O
________Cu+________CO2↑+________H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
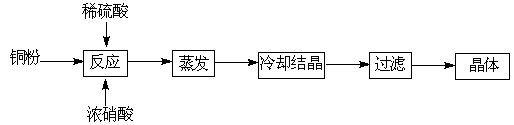
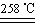 CuSO4+5H2O
CuSO4+5H2O CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2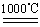 2Cu 2 O+O2↑
2Cu 2 O+O2↑查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将烧瓶中的浓氨水加热 |
| B.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
| C.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热 |
| D.加热试管中的氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
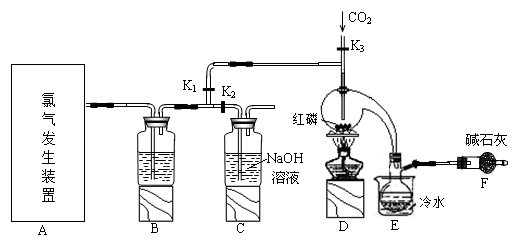
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
| 实验步骤 | 实验现象 | 实验结论 |
| ① | | 溶液X中含有Na+ |
| ② | | 溶液X中含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com