
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( ) 
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
【答案】A
【解析】解:由图可知0﹣10min平衡状态时,X曲线△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲线△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行; A.前10min内用NO2表示的化学反应速率v(NO2)= ![]() =
= ![]() =0.04mol/(Lmin),故A错误;
=0.04mol/(Lmin),故A错误;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),故B正确;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动来实现,故C正确;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,bd点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选A.
由图可知0﹣10min平衡状态时,X曲线△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲线△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)= ![]() ;
;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O![]() 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是
A. 在上述两个反应中,水既不是氧化剂也不是还原剂
B. 在上述两个反应中,氧化产物都是H3PO4
C. 在反应(2)中,当有5molCuSO4发生反应时,共转移10mol电子
D. 在上述两个反应中,氧化剂都只有硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图象说法错误的是( )
A. 图阴影部分面积表示反应物浓度的净减少量M
图阴影部分面积表示反应物浓度的净减少量M
B.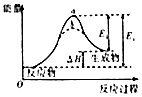 图虚线b表示反应加入催化剂后能量变化曲线
图虚线b表示反应加入催化剂后能量变化曲线
C. 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)2Z(g)
图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)2Z(g)
D. 图对应于反应H2(g)+CO2(g)H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的
图对应于反应H2(g)+CO2(g)H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途.已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为﹣33℃、沸点为114℃.请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为 .
(2)用于微电子器件生产的锡粉纯度测定:①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL.步骤②中加入Fe2(SO4)3的作用是;此锡粉样品中锡的质量分数: .
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下: 
①步骤Ⅰ加入Sn粉的作用:及调节溶液pH.
②步骤Ⅱ用到的玻璃仪器有烧杯、、 .
③步骤Ⅲ生成SnO的离子方程式: .
④步骤Ⅳ中检验SnO是否洗涤干净的操作是 , 证明已洗净.
⑤步骤Ⅴ操作依次为、、过滤、洗涤、低温干燥.
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为 .
实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是 . 
利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水的混合液,分离它们的正确方法依次是( )
A. 分液、蒸馏B. 分液、萃取C. 萃取、分液D. 蒸馏、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷( ![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: 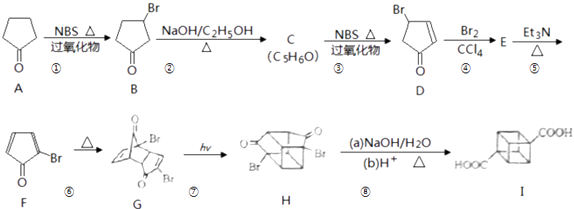
回答下列问题:
(1)C的结构简式为 , E的结构简式为 .
(2)③的反应类型为 , ⑤的反应类型为 .
(3)化合物A可由环戊烷经三步反应合成: ![]()
反应I的试剂与条件为 , 反应2的化学方程式为 , 反应3可用的试剂为 .
(4)在I的合成路线中,互为同分异构体的化合物是 . (填化合物代号)
(5)I与碱石灰共热可化为立方烷.立方烷的核磁共振氢谱中有个峰.
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组拟通过实验,探究Mg(NO3)2受热分解的产物.
小组猜想:ⅰ.固体产物可能有Mg(NO2)2、MgO、Mg3N2中的一种或几种
ⅱ.气体产物可能有NO2、N2、O2中的一种或几种
查得相关资料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO难溶于水.
b.2NO2+2NaOH═NaNO3+NaNO2+H2O
c.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑
针对以上猜想,设计了如图所示实验(图中加热、夹持仪器等装置均省略):
进行实验
Ⅰ.检验上述装置气密性.
Ⅱ.称取3.7gMg(NO3)2固体,置入硬质玻璃管A中,打开K,通入一段时间N2 , 并进行相关物质质量称量
Ⅲ.关闭K,用酒精灯持续给装置A加热,过程中各装置内溶液均未倒吸入其它装置.
Ⅳ.待Mg(NO3)2完全分解,装置冷却至室温,打开K,再缓慢通入一会N2后并再称量.称得A中剩余固体质量为1.0g,B、C、D、E、F中溶液质量分别增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固体于试管中,加入适量水,未出现明显现象.
回答问题
①小组预测一定有O2生成,理由是 .
②N2的电子式是 , 步骤Ⅱ中,通入一段时间N2的目的是 .
③步骤Ⅲ中,装置A内若出现了红棕色气体,其化学式是 .
④装置C中若红色始终未褪,其设计的目的是 .
⑤实验中发现Mg(NO3)2分解时有O2生成,其实验现象是 , 用化学用语解释产生上述现象的原因是 .
⑥实验中Mg(NO3)2分解没有N2生成的理由是 .
⑦Mg(NO3)2分解的化学方程式是 .
⑧装置F中溶液质量增加的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将三份1mol X气体和3mol Y气体分别充入体积为2L的A,B,C三个容器中,发生反应X(g)+3Y(g)2Z(g).2min后反应达到平衡,测得A中剩余0.4mol X,B中Y的平衡浓度为0.5mol/L,C中用Z表示的反应速率为:v(Z)=0.3mol/(Lmin),则这段时间内三个容器中反应速率的大小关系为( )
A.B>A>C
B.A>B=C
C.B>A=C
D.B>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com