


科目:高中化学 来源: 题型:
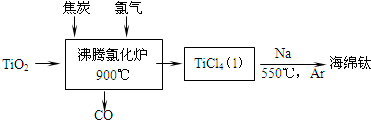
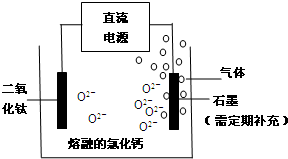
查看答案和解析>>
科目:高中化学 来源: 题型:
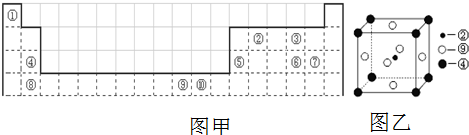
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1KNO3溶液:H+、Fe 2+、SCN -、SO42- | ||
| B、pH=0的溶液:Al3+、Cu(NH3)42+、F -、SO42- | ||
| C、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH被氧化,表现氧化性 |
| B、此条件下还原性强弱为:N2>CH3OH |
| C、若氧化产物比还原产物多0.2mol,则该反应中转移3mol |
| D、该反应过程中断裂的化学键既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、1:2 |
| C、1:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、2.5ρ mol?L-1 | ||
| D、1.25ρ mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com