
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
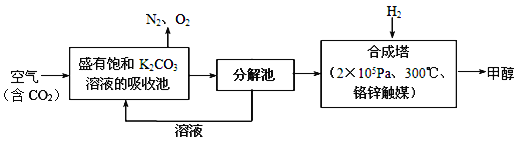
(1)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式____________________________________________________________________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_____________________(至少写两点)。
(3)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
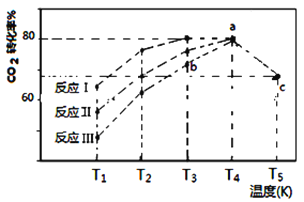
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是__________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)__________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__________________。
④c点时该反应的平衡常数K =_____________。
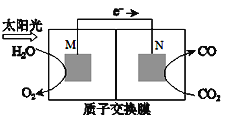
(4)科学家还研究了其它转化温室气体的方法,利用右图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为______________________________________________。
【答案】 CO2(g)+ 3H2(g)![]() H2O(g)+ CH3OH(g) △H=== -53.7kJ/mol 减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用;低碳经济等。(任选两点) 反应I > 该反应为放热反应,温度升高,平衡逆向移动 K=16/3 (或K=5.3) CO2+2H++2e-===CO +H2O
H2O(g)+ CH3OH(g) △H=== -53.7kJ/mol 减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用;低碳经济等。(任选两点) 反应I > 该反应为放热反应,温度升高,平衡逆向移动 K=16/3 (或K=5.3) CO2+2H++2e-===CO +H2O
【解析】本题主要考查化学平衡的移动。
(1)二氧化碳的物质的量为100mol,反应中放出5370kJ的热量,该反应的热化学方程式:CO2(g)+3H2(g)=H2O(g)+CH3OH(g) △H=== -53.7kJ/mol。
(2)该工艺在以下方面体现了“绿色自由”构想中的“绿色”: 减少大气中CO2并产生清洁能源甲醇;K2CO3可循环使用;能量可以循环利用;低碳经济等。
(3)①在相同温度下反应I的转化率最大,所以催化剂效果最佳的反应是反应I。
②b点反应III平衡向正反应方向建立,所以v (正)>v(逆)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是该反应为放热反应,温度升高,平衡逆向移动。
④反应CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g)在c点时各物质的浓度为c(CO2)=1/6mol/L、c(H2)=1/2mol/L、c(H2O)=1/3mol/L、c(CH3OH)=1/3mol/L,该反应的平衡常数K=
H2O(g)+CH3OH(g)在c点时各物质的浓度为c(CO2)=1/6mol/L、c(H2)=1/2mol/L、c(H2O)=1/3mol/L、c(CH3OH)=1/3mol/L,该反应的平衡常数K=![]() =16/3=5.3。
=16/3=5.3。
(4)该装置工作时,在N电极CO2转化为CO,N电极的电极反应式为CO2+2H++2e-===CO+H2O。


科目:高中化学 来源: 题型:
【题目】下列各方法中能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属的内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④
B.①③④⑤
C.①②④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与应用叙述正确的是
A. 浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
B. 碳酸钠溶液有碱性,是治疗胃酸过多的一种药剂
C. SO2具有漂白性,可用于漂白食用粉丝、银耳等物质
D. 浓硫酸具有强氧化性,可用铁制容器存放浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东正在打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以石膏(CaSO4·2H2O)为主要原料制备(NH4)2SO4的流程如下:

下列说法正确的是( )
A. 气体B是NH3,可循环利用
B. 操作Ⅰ中,所用的主要玻璃仪器为烧杯、玻璃棒、分液漏斗
C. 操作Ⅱ中,可用蒸发结晶的方法得到纯净的(NH4)2SO4
D. 整个过程的总反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是

A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。

(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com