

分析 (1)催化剂能降低反应的活化能,加快反应速率,但催化剂不能改变化学平衡,根据图象求算△H,根据热化学方程式的书写方法书写CH3OH(g)和H2O(g)反应的热化学方程式;
(2)根据已知方程式①×6+②×4-③×4构建目标方程式,根据盖斯定律计算反应热,根据热化学方程式的书写方法书写CH3OH(g)、O2(g)反应的热化学方程式;
(3)以CH3OH燃料电池为电源电解法制取ClO2.二氧化氯(ClO2)为一种黄绿色气体,通入O2的电极是正极,负极甲醇失去电子在碱溶液中生成碳酸盐,
①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子在碱溶液中生成碳酸盐;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2,结合电子守恒和电荷守恒配平书写;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,设阳极产生的气体是xmol,则根据电子得失守恒计算.
解答 解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变反应热,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a-b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
故答案为:减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol;
(2)已知:①CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,
②H2O(g)=H2O(l)△H=d kJ/mol,
③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
则根据盖斯定律可知①×6+②×4-③×4即可得到甲醇燃烧生成液态水的热化学方程式为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-(4a-4b-6c-4d)kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2 CO2(g)+4 H2O(l)△H=-(4a-4b-6c-4d)kJ/mol;
(3)①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子,反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:增大,CH3OH-6e-+8OH-=CO32-+6H2O;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2的反应式为:Cl--5e-+2H2O=4H++ClO2↑,
故答案为:Cl--5e-+2H2O=4H++ClO2↑;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol,
故答案为:1.
点评 本题主要是考查催化剂对反应速率、反应热的影响、盖斯定律应用及电化学原理的应用,注意原电池和电解池的原理分析和电极反应书写,题目难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| B. | SO2具有漂白性,可在白葡萄酒中微量添加 | |
| C. | 钠钾合金硬度小,可用作原子反应堆的导热剂 | |
| D. | 酒精能使蛋白质变性,可在医疗上用来杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀NaOH溶液中通入Cl2:Cl2+2OH-═ClO-+Cl-+H2O | |
| B. | 向Fe2(SO4)3溶液中加入铜粉:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 向氨水中通入过量SO2:SO2+OH-═HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
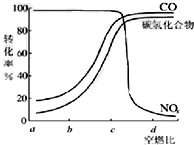 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
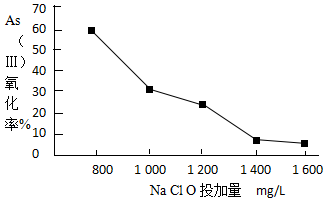
 .
.
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com