
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。
【答案】a;<; ② 白色晶体析出 Na2CO3+CO2+H2O=2NaHCO3↓ 碳酸钠的稳定性强于碳酸氢钠 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】
(1)③同温下,相同浓度下,碳酸钠的水解程度大,碱性强;
④根据n=![]() ,结合方程式可知:质量相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
,结合方程式可知:质量相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
(2)溶解度的高低需要看加水溶解的情况,由实验③现象可知,饱和碳酸钠转变成了碳酸氢钠有白色沉淀生成;
(3)无水CuSO4遇H2O变蓝,CO2能使澄清石灰水变浑浊,根据棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,因此说明碳酸钠的稳定性强于碳酸氢钠。
(1)③碳酸钠水解的离子方程式为CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-;碳酸氢钠水解的离子方程式为HCO3-+H2O
H2CO3+OH-;碳酸氢钠水解的离子方程式为HCO3-+H2O![]() H2CO3+OH-;同温下,相同浓度下,CO32-水解程度大于HCO3-的水解程度,所以碳酸钠溶液的pH大于碳酸氢钠溶液的pH,酚酞遇碱变红,碱性越强,红色越深,因此颜色较深的试管是a;
H2CO3+OH-;同温下,相同浓度下,CO32-水解程度大于HCO3-的水解程度,所以碳酸钠溶液的pH大于碳酸氢钠溶液的pH,酚酞遇碱变红,碱性越强,红色越深,因此颜色较深的试管是a;
④Na2CO3、NaHCO3与盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,根据方程式可知:产生1molCO2,需要Na2CO3质量是106g,需要NaHCO3质量是84g,可见相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
(2)溶解度的高低需要看加水溶解的情况,因此实验②说明了溶解度的高低;Na2CO3+CO2+H2O=2NaHCO3↓,饱和碳酸钠转变成了碳酸氢钠,因为碳酸钠的溶解度大于碳酸氢钠的溶解度,因此有白色沉淀生成;
(3)Na2CO3的热稳定性强于NaHCO3,NaHCO3分解反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,无水CuSO4遇H2O变蓝,产生的CO2能使澄清石灰水变浑浊,因此现象是棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀产生,根据实验现象,棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,说明碳酸钠的稳定性强于碳酸氢钠。
Na2CO3+CO2↑+H2O,无水CuSO4遇H2O变蓝,产生的CO2能使澄清石灰水变浑浊,因此现象是棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀产生,根据实验现象,棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,说明碳酸钠的稳定性强于碳酸氢钠。


科目:高中化学 来源: 题型:
【题目】某学生用 NaOH 标准溶液滴定未知浓度的盐酸,进行了如下实验:
取 15.00mL 待测溶液于 250mL 锥形瓶中,加入 1~2 滴酚酞试液,用 NaOH 标准溶液滴定。按上述操作方 法再重复 2 次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入 NaOH 标准溶液进行滴定,则待测液的浓度_____;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去 NaOH 标准溶液的体积_____;
③滴定时边滴边摇动锥形瓶,眼睛应观察_____;
④滴定达到终点时,酚酞指示剂由_____色变成_____色。
(2)滴定结果如下表所示:

若 NaOH 标准溶液的浓度为 0.1010mol/L,则待测液的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):
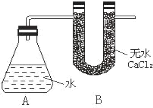
①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B反应前总质量为 m g,反应后 A、B 的总质量为 n g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠浮在水面,产生这一现象原因是:_____________
(2)用 a、m、n 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:


(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. II 和 III 之间 C.I 和 II 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为______________。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有1.56 g Na2O2、3.36g NaHCO3的固体混合物放在密闭容器中加热,最后固体是___________(填化学式),质量为_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废物利用有利于环境保护、资源节约,一种从废催化剂(含ZnO、CuO及少量石墨、Fe2O3及MnO2等)回收铜并制取活性氧化锌的工艺流程如图:
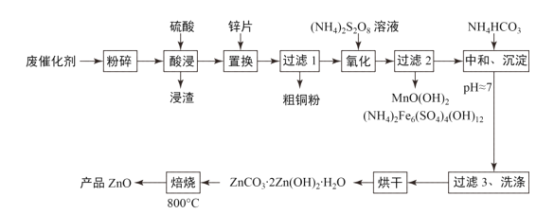
(1)为提高酸浸的速率,还可采取的措施为___。
(2)“氧化”时2molMn2+被氧化为MnO(OH)2,需要(NH4)2S2O8的物质的量为___。
(3)已知Zn(OH)2性质与Al(OH)3类似,在“中和、沉淀”时pH不能过大,请用文字结合离子方程式解释原因___。
(4)“过滤3、洗涤”时,对所得滤液蒸发浓缩、冷却结晶可得___(填主要物质的化学式)固体。
(5)“焙烧”过程中化学方程式为___。
(6)经测定,1kg废催化剂可得160g粗铜粉,又知粗铜粉中铜的质量分数为80%,则废催化剂中铜的质量分数为___%,若“酸浸”时硫酸浓度变小而又没有及时补充,则测定结果会比实际情况___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是( )
A. 常温下,1 L 0.1 mol·L-1 MgCl2溶液中含Mg2+数为0.1NA
B. 常温常压下的33.6 L Cl2与27g Al充分反应,转移电子数为3 NA
C. 1mol单质铁被氧化时一定失去3NA个电子
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)

由上述实验事实可知:
(1)①固体M中一定有的物质是____________(填化学式) 理由是_________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________,B装置的作用_____________。
(3)C装置的作用是______,如果实验中没有B装置,则C装置中产生的现象是_______。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
A.M中有未反应的铁和硫 B.测定气体体积时水准管的水面高于量气管的水面
C.A中留有反应生成的气体 D.气体进入D装置前未用浓硫酸干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如图所示。(提示:Na[Al(OH)4]+HCl→Al(OH)3↓+NaCl+H2O)

(1)混合物中NaOH的质量是________g;AlCl3的质量是________g;MgCl2的质量是________g。
(2)P点所表示盐酸加入体积是________ mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com