
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
【答案】B
【解析】
A.X可以为非氧化剂,如X为NH3,可生成BaSO3沉淀和氯化铵,BaSO3沉淀为白色沉淀,A错误;
B.NaHCO3溶液中存在如下平衡:HCO3-![]() CO32-+H+,加入NaAlO2溶液,生成白色的Al(OH)3沉淀,说明结合H+的能力:AlO2->CO32-,B正确;
CO32-+H+,加入NaAlO2溶液,生成白色的Al(OH)3沉淀,说明结合H+的能力:AlO2->CO32-,B正确;
C.Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,说明有Cu2+生成,试管底有红色沉淀,说明有Cu生成,结合电子得失守恒、电荷守恒、原子守恒可得离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,H+没体现出氧化性,C错误;
D.向2mL0.1mol/LNaOH溶液的试管中滴入2滴0.1mol/LAlCl3没产生白色沉淀的原因是OH-过量,发生的反应为:Al3++4OH-=AlO2-+2H2O,与Ksp无关,D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根据反应①2Fe3++Fe=3Fe2+可知,铁溶解,固体质量减少,根据反应②Cu2++Fe=Cu+Fe2+可知,铁溶解,铜析出,固体质量增加,而反应结束后,称得剩余固体质量与所加铁屑的质量相等,则反应①中固体减少的质量与反应②中固体增加的质量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
【题型】单选题
【结束】
7
【题目】下列说法正确的是( )
A.绿矾是含有一定量结晶水的硫酸亚铁,在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:样品中没有Fe3+,Fe2+易被空气氧化为Fe3+
B.在给定条件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以实现
Fe(OH)2可以实现
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.铁比铜金属性强,故用FeCl3溶液腐蚀印刷电路板上的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是实验室常用的氧化剂。某实验小组制备高锰酸钾,具体流程如图:
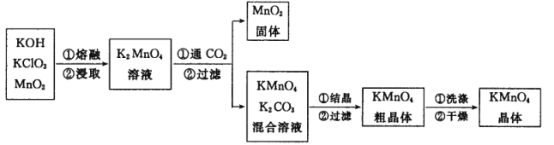
实验一:锰酸钾的制备。称取3.0 g KClO3固体和 7. 0 g KOH固体混合,于铁坩埚中小火加热,待混合物熔融后用铁棒不断搅拌,再加入4.0g MnO2 继续加热。
(1)熔融时加人 MnO2 后坩埚中反应的化学方程式为 _____________。
(2)用铁棒而不用玻璃棒搅拌的原因是______________ 。
实验二:锰酸钾的歧化。待铁坩埚冷凉后放人烧杯中,加水共煮浸取,取出坩埚,开启启普发生器,趁热向溶液中通入CO2,直到溶液绿色全部变为紫色为止,静置沉淀,用砂芯漏斗进行抽滤,留滤液。歧化反应实验装置如图所示:
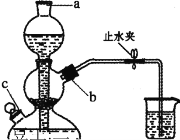
(3)向启普发生器中加入块状固体的位置_______ (选填字母“a”“b”或“ c”)。该仪器的优点是方便控制反应的发生与停止,其原理是_____________。
(4)烧杯中锰酸钾歧化反应的化学方程式为___________________。
(5)锰酸钾歧化时不能用盐酸代替 CO2,原因是_______________ 。
实验三:锰酸钾的浓缩结晶。将滤液转移至蒸发皿中,蒸发浓缩,自然冷却结晶,抽滤至干。将晶体转移至已知质量的表面皿上,放入烘箱中 80℃ 干燥半小时左右,冷却,称量,产品质量为 3.16 g。
(6)蒸发浓缩滤液至___________停止加热。
(7)该实验小组制备高锰酸钾的产率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是
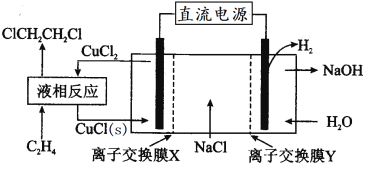
A.该装置工作时,阳极的电极反应是CuCl(s)+Cl--e-=CuCl2
B.液相反应为CH2=CH2+2CuCl2=ClCH2CH2Cl+2CuCl(s)
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+2NaCl+2H2O![]() ClCH2CH2Cl+2NaOH+H2↑
ClCH2CH2Cl+2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___(填元素名称),氧化剂是___(填化学式)。
②配平该方程式:__NH3+__Cl2—__N2+__HCl
③根据上述反应,工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是___,产生该现象的反应方程式为___。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为___。
②反应II属于___反应。(填四种基本反应类型之一)。
③若要制得a个氯气分子,则整个反应中转移电子的个数为___个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:
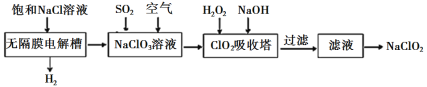
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:_________。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________(写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为________,H2O2的电子式为________。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②______;③用38℃~60℃热水洗涤; ④低于60℃干燥,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_______g·L1(杂质不参与反应,NaClO2中的氯元素被还原为Cl)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
A.  图中:实验现象证明氯气无漂白作用,氯水有漂白作用
图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.  图中:收集氯气
图中:收集氯气
C. 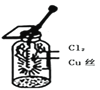 图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
D.  图中:若气球干瘪,证明可与NaOH溶液反应
图中:若气球干瘪,证明可与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com