
���� Zԭ�������������Ǵ�����������3����Z��2�����Ӳ㣬�������6�����ӣ���ZΪOԪ�أ�Y���⻯���������3�����ۼ���˵������������Ϊ5����Y��ZΪͬ���ڵ�����Ԫ�أ���YΪNԪ�أ�Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ���W��������=5+6=11��ΪNaԪ�أ�X��Wͬ���壬��XΪHԪ�أ��ݴ˽��н��
��� �⣺Zԭ�������������Ǵ�����������3����Z��2�����Ӳ㣬�������6�����ӣ���ZΪOԪ�أ�Y���⻯���������3�����ۼ���˵������������Ϊ5����Y��ZΪͬ���ڵ�����Ԫ�أ���YΪNԪ�أ�Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ���W��������=5+6=11��ΪNaԪ�أ�X��Wͬ���壬��XΪHԪ�أ�
��1��������������֪��XΪHԪ�أ�YΪNԪ�أ�
�ʴ�Ϊ��H��N��
��2��WΪNaԪ�أ�ԭ�Ӻ�����3�����Ӳ㣬����������Ϊ1����Ӧλ�ڵ������ڢ�A�壬
�ʴ�Ϊ���������ڢ�A�壻
��3����X��Y��Z���γɵ����ӻ�����ΪNH4NO3����NaOH��Һ��Ӧ����NH3•H2O����Ӧ�����ӷ���ʽΪNH4++OH-=NH3•H2O��
�ʴ�Ϊ��NH4NO3��NH4++OH-=NH3•H2O��
���� ���⿼��ṹ����λ�õĹ�ϵ����Ŀ�Ѷ��еȣ��ƶ�Ԫ��Ϊ���ؼ���ע����������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ��������ؿ���ѧ���ķ������������Ӧ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ý�ͷ�ι����Թܵ�Һ��ʱ���ιܼ�����Թ��ڱ� | |
| B�� | ���˲����У�©�������ձ��ڱ� | |
| C�� | ��Һ�����У���Һ©�������ձ��ڱ� | |
| D�� | ���˲����У���������������ֽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
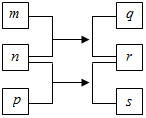 ������Ԫ��W��X��Y��Z��ԭ�������������ӣ�n��p��q������ЩԪ����ɵĶ�Ԫ�����m��Ԫ��Y�ĵ��ʣ�p��һ�ֵ���ɫ��ĩ��q��ˮ��Һ���ڲ���������ʴ�̱�ǣ�0.01mol•L-1s��Һ��pHΪ12���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
������Ԫ��W��X��Y��Z��ԭ�������������ӣ�n��p��q������ЩԪ����ɵĶ�Ԫ�����m��Ԫ��Y�ĵ��ʣ�p��һ�ֵ���ɫ��ĩ��q��ˮ��Һ���ڲ���������ʴ�̱�ǣ�0.01mol•L-1s��Һ��pHΪ12���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ���Ӱ뾶��X��Y��Z | |
| B�� | �����ԣ�r��m | |
| C�� | p��q�о��������Ӽ� | |
| D�� | �������Ũ�ȵ�q��Һ��s��Һ��Ӧ����Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ʼ�С�ķ�Ӧͨ�����Է��ģ��ܹ��Է����еķ�Ӧ�����ʼ�С�ķ�Ӧ | |
| B�� | �����ӵķ�Ӧͨ�����Է��ģ��ܹ��Է����еķ�Ӧ���������ӵķ�Ӧ | |
| C�� | �����£���ӦC��s��+CO2��g���T2CO��g�������Է����У���÷�Ӧ�ġ�H��0 | |
| D�� | ��H��0�ҡ�S��0�ķ�Ӧһ�����Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���Ļ����������������й㷺���ڣ�
���Ļ����������������й㷺���ڣ� ����ͨ����ӦNH3��g��+Cl2��g��=NH2Cl��g��+HCl��g���Ʊ��Ȱ�����֪���ֻ�ѧ���ļ��������ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�ġ�H=+11.3kJ•mol-1��
����ͨ����ӦNH3��g��+Cl2��g��=NH2Cl��g��+HCl��g���Ʊ��Ȱ�����֪���ֻ�ѧ���ļ��������ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�ġ�H=+11.3kJ•mol-1��| ��ѧ�� | ����/��kJ•mol-1�� |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n��NO������������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n��NO������������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n��NO������������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ʰ��ᣨNH2CH2COOH�� | ������ | �ʰ������� |
| ������ˮ�������Ҵ������Ի����� | ������ˮ���Ҵ�����ǿ���Ժͻ�ԭ�� | ������ˮ���������Ҵ� |
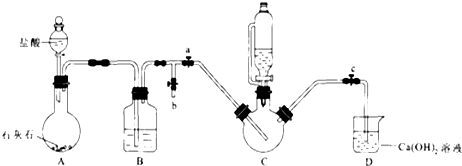
| ʵ�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| ��ϵpH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| ����/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
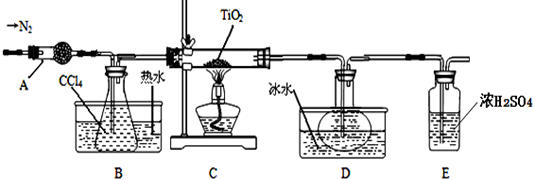
| ���� | �۵�/�� | �е�/�� | ���� |
| CCl4 | -23 | 76 | ��TiCl4���� |
| TiCl4 | -25 | 136 | ����ʪ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2NO2�TO2+2NO����H=+116.2kJ/mol��ȼ���ȣ� | |
| B�� | 2S��s��+2O2��g���T2SO2��g������H=-269.8kJ/mol��ȼ���ȣ� | |
| C�� | NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l������H=-57.3kJ/mol���к��ȣ� | |
| D�� | C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��g������H=-1367.0��kJ/mol��ȼ���ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
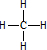 ��B��������6��ԭ�ӹ��棬�ṹ��ʽΪCH2=CH2��
��B��������6��ԭ�ӹ��棬�ṹ��ʽΪCH2=CH2���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com