
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。
(1)下列关于烃A和烃B的说法中不正确的是_____(填字母编号)。
a、烃A和烃B可能互为同系物
b、烃A和烃B可能互为同分异构体
c、当m=12时,烃A一定为烷烃
d、当n=11时,烃B可能的分子式有两种
e、烃A和烃B可能都为芳香烃
(2)若烃A为链状烃,且分子中所有碳原子都在一条直线上,则A的结构简式为____。
(3)若烃A为链状烃,分子中所有碳原子不可能都在同一平面上。在一定条件下,1mol A最多只能与1mol H2发生加成反应。写出烃A的名称:_______。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,再通过足量碱石灰,碱石灰增重4.4g,则烃B的分子式为______。
(5)有机物CH3CH(C2H5)CH(CH3)(CH2)3 CH3的系统命名是_______,1mol该有机物完全燃烧需消耗标准状况下氧气___L。
(6)请写出下列化合物所含官能团的名称:
①CH3CH=CH2:______; ② :______; ③
:______; ③ :______。
:______。
【答案】de ![]() 3-甲基-1-丁烯 C10H14 3,4-二甲基辛烷 347.2 碳碳双键 羟基 酯基
3-甲基-1-丁烯 C10H14 3,4-二甲基辛烷 347.2 碳碳双键 羟基 酯基
【解析】
(1)a、当A为C5H10,B为C10H20的烯烃时,烃A和烃B互为同系物, a项正确;
b、当m=n时,A与B分子式相同,结构不同时,互为同分异构体;
c、烷烃的通式是CnH2n+2(n≥1);
d、当n=11时,最简式为C5H11的有机物只能是C10H22;
e、烃A的分子中只含有5个碳原子,不能形成芳香烃;
(2)与碳碳三键直接相连的原子共线,因此,要使5个碳原子共线,结构中需含有2个碳碳三键;
(3)链烃A与H2最多以1:1加成,可知A为烯烃C5H10,分子中所有碳原子不可能共面,说明碳原子形成了四面体结构;
(4)B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,增重的质量为水的质量,再通过足量碱石灰,碱石灰增重4.4g,增重的是CO2的质量,计算C和H的物质的量求比值可得分子式;
(5)根据有机物的结构简式找到最长的碳链,编号确定支链的位置进行命名,根据分子式确定完全燃烧消耗氧气的体积;
(6)根据有机物的结构确定官能团的名称。
(1)a、当A为C5H10,B为C10H20的烯烃时,烃A和烃B互为同系物;
b、当m=n时,A与B分子式相同,结构不同时,互为同分异构体,b项正确;
c、烷烃的通式是CnH2n+2(n≥1),当m=12时,分子式为C5H12,符合烷烃的通式,属于烷烃,c项正确;
d、当n=11时,最简式为C5H11的有机物只能是C10H22,d项错误;
e、烃A的分子中只含有5个碳原子,不可能形成芳香烃,e项错误;
因此错误的是de;
(2)与碳碳三键直接相连的原子共线,因此,要使5个碳原子共线,结构中需含有2个碳碳三键,因此有机物A为:![]() ;
;
(3)链烃A与H2最多以1:1加成,可知A为烯烃C5H10,分子中所有碳原子不可能共面,说明碳原子形成了四面体结构,该有机物为3-甲基-1-丁烯;
(4)n(CO2)=![]() =0.1mol,n(H2O)=
=0.1mol,n(H2O)=![]() =0.07mol,n(H)=0.07mol×2=0.14mol,n(C):n(H)=0.1:0.14=5:7,因此最简式为C5H7,B为苯的同系物,通式为CnH2n-6,n:(2n-6)=5:7,解得n=10,所以B的分子式为C10H14;
=0.07mol,n(H)=0.07mol×2=0.14mol,n(C):n(H)=0.1:0.14=5:7,因此最简式为C5H7,B为苯的同系物,通式为CnH2n-6,n:(2n-6)=5:7,解得n=10,所以B的分子式为C10H14;
(5)根据有机物的结构简式可知,最长的碳链上有8个碳原子,为辛烷,在3号碳和4号碳上分别连有一个甲基,因此该有机物的名称为3,4-二甲基辛烷;该有机物的分子式为C10H22,1mol该有机物完全燃烧时消耗氧气的物质的量为10+![]() =15.5mol,标况下的体积为:15.5mol×22.4L/mol=347.2L;
=15.5mol,标况下的体积为:15.5mol×22.4L/mol=347.2L;
(6)根据有机物的结构可知:①中的官能团为碳碳双键;②中的官能团为羟基;③中的官能团为酯基。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置用环己醇制备环己烯,装置如图1所示。

已知: +H2O。
+H2O。
密度/ g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①试管A中碎瓷片的作用是___,导管B除了导气外还具有的作用是__。
②将试管C置于冰水中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在___(填“上”或“下”)层,分液后用___(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将提纯后的环己烯按如图2所示装置进行蒸馏,冷却水从__(填字母)口进入,目的是___。蒸馏时要加入生石灰,目的是___。

③收集产品时,应控制温度在___左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___(填字母)。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗产品时环己醇随产品一起蒸出
(3)以下用来区分环己烯精品和粗品的试剂或方法中,合理的是__(填字母)。
a.酸性高锰酸钾溶液 b.金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把6 mol A和5 mol B通入容积为4L的恒容密闭容器中发生反应3A(g)+B(g)![]() 2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是
2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是

A.t2=5min,平衡时3v正(A)=2v逆(D)
B.0~t2,A的平均反应速率为0.15 mol·L-1·min-1
C.t2~t3,各物质的浓度一定相等
D.B的平衡转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素。A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能。E是第四期第IB族元素,回答下列问题:
A | B | |
D |
⑴E原子的基态电子排布式 ______;
⑵A、B、C三种元素的第I电离能由大到小的顺序是 ______;
⑶D能形成多种价态的含氧酸,其酸性由强到弱的顺序为 ______;
⑷已知金属C单质的晶胞为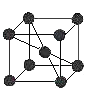 ,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
⑸向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为![]() 写真实符号
写真实符号![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是__________________________;A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________________。分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是________________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强是________________(用具体的化学键表示)。
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是_______。
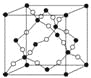
a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。

(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是_______(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项)。
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2 ③![]() ④ CH3CH3
④ CH3CH3
A. ①②③④B. ③④
C. ①②④D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )

A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
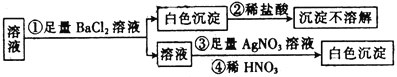
A.原溶液中一定只含有SO![]()
B.原溶液中一定含有SO![]() 和Cl-
和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有SO![]() ,也可能含有Cl-
,也可能含有Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com