
| A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D、氯气通入水中:Cl2+H2O?H++HClO+Cl- |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、选择仪器时,使用240 mL容量瓶 |
| B、将烧杯中已恢复至室温的氢氧化钠溶液注入未经干燥的洁净容量瓶中 |
| C、将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解 |
| D、在摇匀后发现液面低于了刻度线,继续用胶头滴管滴加至刻度线与凹液面相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池的负极反应:O2+2H2O+4e-═4OH- |
| B、惰性材料做电极电解饱和食盐水时,阳极的电极反应为:2Cl--2e-═Cl2↑ |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+H2O?H2CO3 |
| B、OH-+HS-?S2-+H2O |
| C、HS-+H2O?H3O++S2- |
| D、HS-+H2O?H2S+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:
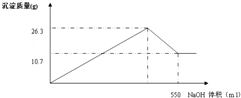
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均存在电离平衡和水解平衡 |
| B、存在的粒子种类相同 |
| C、c(OH-)前者大于后者 |
| D、分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com