
| A. | 生物质能来源于植物及其加工产品所存贮的能量,绿色植物通过光合作用将化学能转化成生物质能 | |
| B. | 2015年8月国内油价再次迎来成品油最高零售价的下调,上演了年内首场“四连跌”,但油品从国Ⅳ汽油升级到Ⅴ汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温下可用金属钠还原四氯化钛来制取金属钛 | |
| D. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属 |
分析 A.绿色植物通过光合作用将光能转化为生物质能;
B.从国Ⅳ汽油升级到Ⅴ汽油,可降低汽油中的含硫量;
C.钠与熔融的盐反应发生置换反应,生成相应的单质;
D.元素分析仪作为一种实验室常规仪器,可同时对有机的固体、高挥发性和敏感性物质中C、H、O、N、S、Cl、Br等元素的含量进行定量分析测定.
解答 解:A.生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,即以生物质为载体的能量.它直接或间接地来源于绿色植物的光合作用,所以生物质能来源于植物及其加工产品所贮存的能量,绿色植物通过光合作用将光能转化为生物质能,故A错误;
B.从国Ⅳ汽油升级到Ⅴ汽油,可降低汽油中的含硫量,可减少酸雨、雾霾,提高空气质量,故B正确;
C.钠与熔融的盐反应发生置换反应,生成相应的单质,所以高温时可用金属钠还原相应的氯化物来制取金属钛,故C正确;
D.元素分析仪作为一种实验室常规仪器,可同时对有机的固体、高挥发性和敏感性物质中C、H、O、N、S、Cl、Br等元素的含量进行定量分析测定,故D正确.
故选A.
点评 本题考查较为综合,涉及能量的转化、物质的分离、金属的冶炼以及物质的测定等知识,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生的学习的积极性,难度不大.


科目:高中化学 来源: 题型:多选题
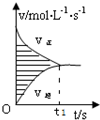 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )| A. | 反应起始时,X、Y、Z 三种物质同时存在 | |
| B. | t1 时刻,X、Y、Z 浓度不再发生变化,反应停止 | |
| C. | 若该反应在更大的压强下进行,达平衡时,阴影部分面积不变 | |
| D. | 若该反应在加入催化剂的条件下进行,达平衡时,阴影部分面积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
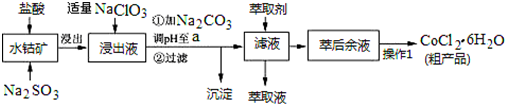
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
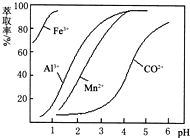
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
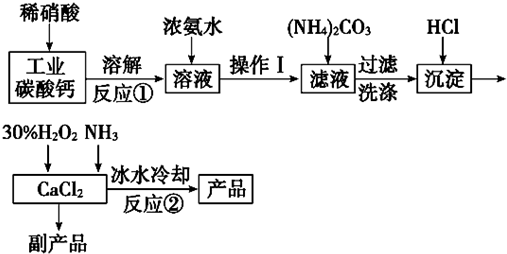
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2mol H2完全燃烧时液态水放热572kJ | |
| B. | 相同条件下,2mol H2O完全分解吸收热量572kJ | |
| C. | 相同条件下,1mol H2充分燃烧生成气态水放热大于286kJ | |
| D. | 形成1mol H2O的化学键所释放的能量大于断裂lmol H2和0.5mol O2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
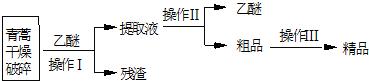
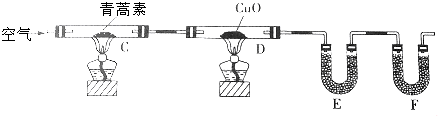
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报列入的首要主要污染物有二氧化硫、二氧化氮和可吸入颗粒物等 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 含磷合成洗涤剂直接排放会导致水体污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com