
| A. | C(SO42-)为0.1mol/L | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | K+可能存在 | D. | Ba2+一定不存在,Ca2+可能存在 |
分析 ①加入AgNO3溶液没有沉淀产生,说明溶液中不存在Cl-;
②加足量NaOH溶液加热后产生0.04mol为氨气,溶液中一定含有NH4+,并且物质的量为0.04mol;
③加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g,2.33g为硫酸钡,6.27g为硫酸钡和碳酸钡;
再根据电荷守恒,得出一定存在钾离子.
解答 解①加入AgNO3溶液没有沉淀产生,说明溶液中不存在Cl-;
②加足量NaOH溶液加热后产生0.04mol为氨气,溶液中一定含有NH4+,并且物质的量为0.04mol;
③不溶于盐酸的2.33g为硫酸钡,物质的量是0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为0.02mol,故一定存在CO32-、SO42-,因而一定没有 Mg2+、Ba2+;
n(CO32-)=0.02 mol,
再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;c(-)=2c(CO32-)+2x(SO42-)=0.06mol,故一定有K+,至少0.02mol;
综合以上可以得出,一定存在的离子有NH4+、K+、CO32-、SO42-,一定没有的离子Cl-、Mg2+、Ba2+;
A、根据以上推断,C(SO42-)为0.1mol/L,故A正确;
B、碳酸根离子的物质的量是0.02mol,故B错误;
C、K+一定存,故C错误;
D、溶液中一定没有 Mg2+、Ba2+,故D错误.
故选A.
点评 本题考查常见阴、阳离子的检验,涉及到用电荷守恒推断离子的存在,是本题中容易出错的地方,做题时需要细致分析,本题难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑
(1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
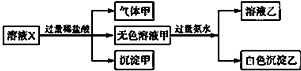
| A. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| B. | HCO3-和SO42-一定不存在于溶液X中 | |
| C. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| D. | 溶液中一定存在大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
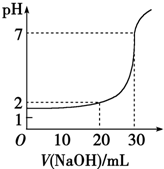 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )| A | B | C | D | |
| c(HCl)/mol•L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH)/mol•L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com