
A、 过滤 |
B、 渗析 |
C、 萃取 |
D、 丁达尔效应 |


科目:高中化学 来源: 题型:
| A、1mol甲醇中含有C-H键的数目为4NA |
| B、标准状况下,2.24L已烷含有分子的数目为0.1NA |
| C、12克金刚石中含有的共价键数目为2NA |
| D、1 mol 甲基所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 该图表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B、 该图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数 |
C、 图表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1草酸溶液混合 |
D、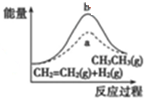 图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH2(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液中NH4+和Cl-数目 | ||
| B、纯水在100℃和25℃时的pH | ||
| C、完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol?L-1盐酸体积 | ||
D、CH3COONa溶液加水稀释前后的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两个探究性学习小组,拟在实验室中通过铝与足量的稀硫酸反应生成的氢气来测定铝的摩尔质量.
甲、乙两个探究性学习小组,拟在实验室中通过铝与足量的稀硫酸反应生成的氢气来测定铝的摩尔质量.| 实验前 | 实验后 | |
| 铝铜合金质量/g | m1 | m2 |
| 量液管(C)液面读数/mL | V1 | V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com