
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
分析 (1)根据盖斯定律书写目标热化学方程式;
(2)①利用lgK与K是增比例函数,温度越高K值越小,说明正反应是放热反应;
②当lgK=1,则K=10,根据平衡常数表达式求出混合气体中CO的体积分数;
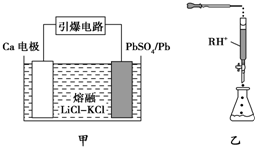
(3)原电池电极反应方程式的书写,首先根据装置图,判断正负极,然后书写正极电极反应方程式;
(4)要计算出t℃时PbI2 Ksp,求溶液中C(I-)、C(Pb2+)的值,然后根据公式求出结果;
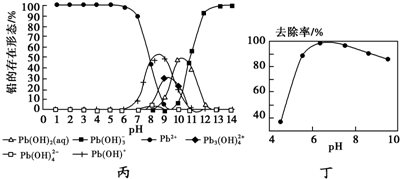
(5)①由图1,常温下,pH=6→7时,Pb2+变成Pb(OH)+是因为Pb2+水解的原故;
②由图2分析铅的去除率较高时,pH大约为6.5左右,结合图1pH大约为6.5左右时的铅的形式为Pb2+.
解答 解:(1)①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H1=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H2=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H3=c kJ•mol-1
根据盖斯定律①×2+②×-③×3得到3PbS(s)+6O2(g)═3PbSO4(s)△H=2△H1+2△H2-3△H3=(2a+2b-3c)kJ•mol-1,
故答案为:2a+2b-3c;
(2)①利用lgK与K是增比例函数,温度越高K值越小,说明正反应是放热反应,
故答案为:<;
②lgK=1,则K=10,在PbO(s)+CO(g)?Pb(s)+CO2(g)中设起始通入CO的amol/l,达平衡时转化的量为xmol/l,平衡时CO浓度为(a-x)mol/l,CO2的浓度为xmol/l,则K=$\frac{x}{a-x}$=10,得$\frac{x}{a}$=9.09%,
故答案为:9.09%;
(3)根据装置图,判断正极为PbSO4发生还原反应,电极反应式为:PbSO4+2e-═SO42-+Pb (或PbSO4+Ca2++2e-═CaSO4+Pb),
故答案为:PbSO4+2e-═SO42-+Pb (或PbSO4+Ca2++2e-═CaSO4+Pb);
(4)滴定过程中消耗的OH-,即为阳离子交换出的H+,C(H+)=0.0025mol•L-1×20.00mL÷25.00mL=2×10-3mol•L-1,由2RH++PbI2=R2Pb2++2H++2I-,可知C(H+)=C(I-),而C(Pb2+)=C(I-)/2=10-3mol•L-1,所以KSp(PbI2)=C(Pb2+)×C(I-)2=10-3×(2×10-3)2=4×10-9,
故答案为:4×10-9;
(5))①由图1,常温下,pH=6→7时,Pb2+变成Pb(OH)+是因为Pb2+水解,Pb2++H2O?Pb(OH)++H+,
故答案为:Pb2++H2O?Pb(OH)++H+;
②由图2分析铅的去除率较高时,pH大约为6.5左右,结合图1pH大约为6.5左右时的铅的形式为Pb2+,
故答案为Pb2+.
点评 本题综合性较大,涉及盖斯定律的运用、平衡移动、化学平衡常数、电极反应式的书写、盐类水解等,难度中等,是对学生综合能力的考查.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 18.75% | B. | 30% | C. | 15% | D. | 22.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该 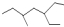 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 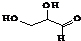 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 操作 | 现象 |
| 向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体) | 溶液颜色变蓝(或绿色加深) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与2H2O的混合物中所含中子数约为6.02×1023 | |
| B. | 2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,说明该反应的△H<0 | |
| C. | 向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清,说明苯酚的酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
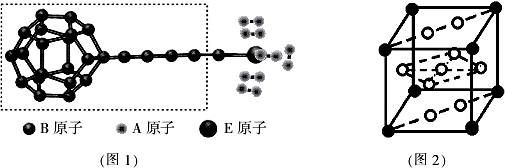
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 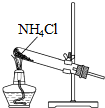 制取氨气 | B. | 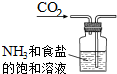 制取NaHCO3 | C. | 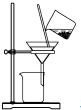 分离NaHCO3 | D. |  干燥NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com