
 B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如图,由此图可得出: 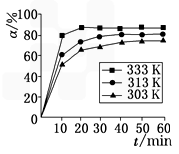
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:黑龙江省大庆实验中学2011-2012学年高二上学期期中考试化学试题 题型:058
向两支分别盛有0.1 mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1)________,三种酸由强到弱的顺序是(用化学式表示)(2)________,硼酸(H3BO3)在食品、医药领域应用广泛.
(3)请完成B2H6气体与水反应的化学方程式:B2H6+6H2O=2H3BO3+________.
(4)在其他条件相同时,反应H3BO3+3CH3OH B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:

①温度对应该反应的反应速率和平衡移动的影响是________.
②该反应的ΔH________0(填“<”、“=”或“>”).
(5)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)
[B(OH)4]-(aq)+H+(aq)
已知0.70 mol·L-1 H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5 mol·L-1,c平衡(H3BO3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K=________,(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
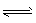 B(OCH3)3 +3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,
B(OCH3)3 +3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,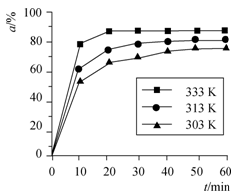
 [B(OH)4]-(aq)+H +(aq)已知0.70 mol/L H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5 mol/L,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K_________H2O的平衡浓度不列入K的表达式中(计算结果保留两位有效数字)。
[B(OH)4]-(aq)+H +(aq)已知0.70 mol/L H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5 mol/L,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K_________H2O的平衡浓度不列入K的表达式中(计算结果保留两位有效数字)。查看答案和解析>>
科目:高中化学 来源:广东省高考真题 题型:计算题
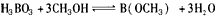 中,H3BO3 的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
中,H3BO3 的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出: 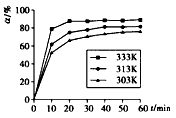
 已知0.70 mol·L-1H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+) =2.0×10-3mol·L-1,C平衡( H3BO3)≈c起始( H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
已知0.70 mol·L-1H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+) =2.0×10-3mol·L-1,C平衡( H3BO3)≈c起始( H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com