
【题目】下列行为不会对环境造成污染的是( )
A.将生活垃圾就地焚烧B.大量使用农药以防治病虫害
C.大力提倡使用空调D.工业废水经处理后循环再用
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)_______。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各物质按酸、碱、盐分类顺序排列,正确的是 ( )
A.盐酸、烧碱、胆矾B.硫酸、纯碱、食盐
C.碳酸、乙醇、醋酸钠D.磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
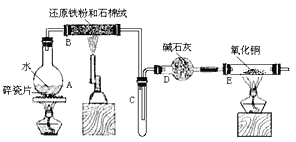
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
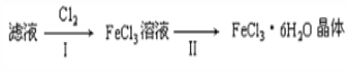
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法中正确的是( )
A.物质的量是表示物质质量的物理量
B.物质的量是表示物质多少的物理量
C.物质的量是含有一定数目粒子集合体的物理量
D.物质的量既可表示物质的质量又可表示物质的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
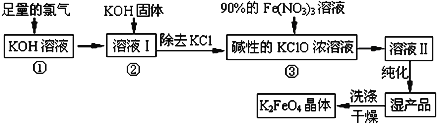
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 =5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)的情况下进行;
(2)在溶液I中加入KOH固体的目的是________(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________________________________ 。
(4)如何判断K2FeO4晶体已经洗涤干净________________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A,C同周期,B,C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:______________________。
(3)写出下列物质的电子式:
①D元素形成的单质:_______________________________________________。
②E与B形成的化合物:_____________________________________________。
③A,B,E形成的化合物:___________________________________________。
④D与E形成的化合物:______________________________________________。
⑤C,D,E形成的离子化合物:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙烯基苯甲酸是重要的医药中间体,广泛应用于合成感光材料。对乙烯基苯甲酸可通过如下反应合成。
反应①: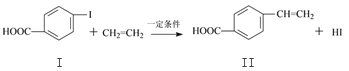
(1)下列关于化合物I和化合物Ⅱ的说法,正确的是______________。
a.化合物I能与新制的Cu(OH)2反应 b.均可发生酯化反应和银镜反应
c.化合物Ⅱ能使KMnO4溶液褪色 d.1 mol化合物Ⅱ最多能与5 mol H2反应
(2)化合物Ⅱ在催化剂条件下生成高分子化合物的反应方程式为_____________。
(3)化合物Ⅱ可由芳香族化合物Ⅲ通过消去反应获得,Ⅲ和Cu共热的产物能发生银镜反应,写出化合物Ⅲ的结构简式__________________________。
(4)化合物Ⅳ是化合物Ⅱ的同分异构体,且化合物Ⅳ遇FeCl3溶液显紫色,苯环上的一氯代物只有2种,写出化合物Ⅳ的结构简式________________________(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:__________。
(2)根据下列微粒回答问题:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、37Cl2
、37Cl2
①以上8种微粒共有________种核素,共________种元素。
②互为同位素的是________________。
③中子数相等的是_______________。
(3)相同物质的量的14CO与18O2的质量之比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com