
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |

| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| ||
|
| K1 |
| K2 |
| 1.47 |
| 2.36 |
| 2.15 |
| 1.67 |
| K1 |
| K2 |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
| A、N5+常温下会剧烈爆炸,体积急剧膨胀,放出大量的热 |
| B、N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料 |
| C、N2、N3、N5、N5+、N60互为同素异形体 |
| D、含N5+的化合物中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(SO3) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
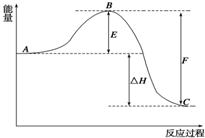 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com