
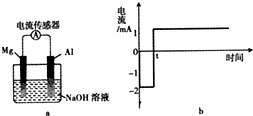
 将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )
将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )| A. | 实验过程中,铝电极表面可能有气泡产生 | |
| B. | 0-t时刻,镁电极上发生反应:Mg-2e-+2OH-=Mg(OH)2 | |
| C. | t时刻时,铝和镁的金属活动性相同 | |
| D. | t时刻后,电池主要的总反应方程式:4Al+3O2+4OH-=4AlO2-+2H2O |
分析 A、实验过程中,铝电极表面是水电离产生的氢离子放电,生成氢气;
B、0-t时刻,镁作为负极失去电子,生成镁离子,镁离子与氢氧根离子结合生成氢氧化镁:
C、指针未偏转,说明未形成电流;
D、t时刻后,铝是负极发生氧化反应,镁是正极,发生还原反应,水电离产生的氢离子在正极放电.
解答 解:A、起始时镁作负极,铝电极表面是水电离产生的氢离子放电,生成氢气,所以铝电极表面可能有气泡产生,故A正确;
B、0-t时刻,镁作为负极失去电子,生成镁离子,镁离子与氢氧根离子结合生成氢氧化镁,所以电极反应式为:Mg-2e-+2OH-=Mg(OH)2,故B正确:
C、指针未偏转,说明未形成电流,但镁、铝的活动性不同,故C错误;
D、t时刻后,铝是负极发生氧化反应,镁是正极,发生还原反应,水电离产生的氢离子在正极放电,电极反应的总方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D错误;
故选CD.
点评 本题考查了原电池和电解池原理,正确推断原电池中正负极是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,合成E和高分子树脂N的路线如图1所示:
,合成E和高分子树脂N的路线如图1所示: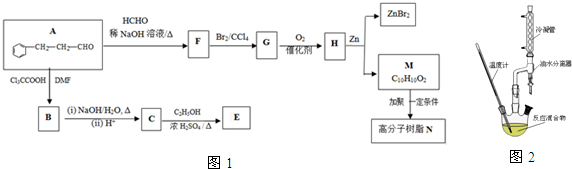
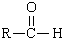 $→_{DMF}^{CI_{3}CCOOH}$
$→_{DMF}^{CI_{3}CCOOH}$ $→_{(ii)H+}^{(i)NaOH/H_{2}O,△}$
$→_{(ii)H+}^{(i)NaOH/H_{2}O,△}$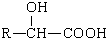
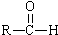 +
+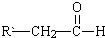 $→_{△}^{稀NaOH溶液}$
$→_{△}^{稀NaOH溶液}$
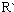 表示烃基或氢原子)
表示烃基或氢原子)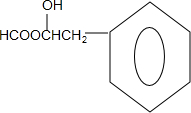
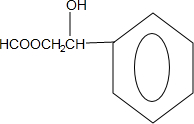 .
.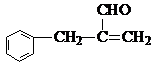 ;N的结构简式为
;N的结构简式为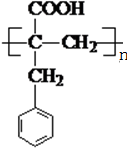 .
.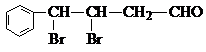 ,下列有关X的说法正确的是ac(填标号).
,下列有关X的说法正确的是ac(填标号).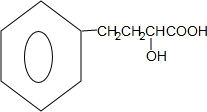 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$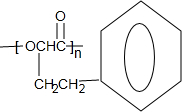 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖注射液能产生丁达尔效应 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| D. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
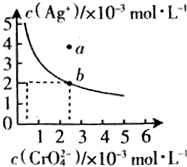 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置 |  |  H2(g)+I2(g)?2HI(g) |  |  |
| 目的 | 检验碳与浓硫酸反应的氧化产物 | 验证压强对化学平衡的影响 | 检查碱式滴定管是否漏液 | FeSO4溶液的蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp(Mg(OH)2)>Ksp(Cu(OH)2) |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度的Na2SO4和Na2CO3的混合溶液中添加BaCl2溶液,BaSO4先析出 | |
| B. | 向BaCO3的悬浊液中加入少量的新制氯水,r(Ba2+)增大 | |
| C. | BaSO4和BaCO3共存的悬浊液中,c(SO42-)/c(CO32-)=1/26 | |
| D. | 向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )| A. | 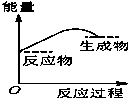 | B. | 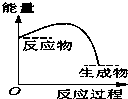 | C. | 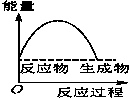 | D. | 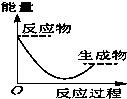 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com