
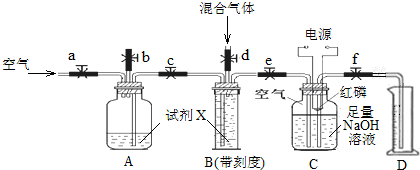
分析 (1)依据装置图中的实验原理,试剂X是要将装置B中定量量取的一定体积的气体入挤压到C、D装置,所以X试剂不能溶解N2、O2、CO2三种气体中的任何一种,所以X只能是饱和NaHCO3溶液,利用焰色反应检验钠离子,根据碳酸氢根离子与钙离子不沉淀,与酸反应能产生无色无味气体使澄清石灰水变浑的特点检验碳酸氢根离子;
(2)红磷燃烧消耗氧气,红磷过量可以充分吸收氧气;
(3)装置C中氢氧化钠溶液,吸收二氧化碳反应生成碳酸钠,氢氧化钠溶液要足量,磷与氧气反应生成五氧化二磷与氢氧化钠反应生成磷酸钠,据此答题;
(4)分析实验过程可知,V1为呼入的气体体积,V2为除净二氧化碳的呼入气体,V3为氮气的体积,依据气体体积变化计算氧气和二氧化碳的体积比,若步骤⑤中C瓶还未冷却到室温就打开止水夹f,立即读出量筒D的读数,则读出的V3偏大,据此分析.
解答 解:(1)依据装置图中的实验原理,试剂X是要将装置B中定量量取的一定体积的气体入挤压到C、D装置,所以X试剂不能溶解N2、O2、CO2三种气体中的任何一种,所以X只能是饱和NaHCO3溶液,故选Ⅲ,利用焰色反应检验钠离子,检验碳酸氢根离子的实验方案为:取试剂X于试管中,加入氯化钙溶液,无明显现象,再加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体(排除二氧化硫),说明原溶液中含碳酸氢根离子,
故答案为:Ⅲ;焰色反应;取试剂X于试管中,加入氯化钙溶液,无明显现象,再加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体(排除二氧化硫),说明原溶液中含碳酸氢根离子;
(2)C装置中红磷是为了燃烧消耗呼入气体中的氧气来测定气体体积分数,要过量的目的是消耗完C中的O2,
故答案为:消耗完C中的O2;
(3)装置C中是氢氧化钠溶液,吸收二氧化碳反应生成碳酸钠,红磷燃烧生成的五氧化二磷在溶液中反应生成磷酸钠,所以溶液中溶质为NaOH、Na2CO3、Na3PO4,
故答案为:吸收混合气体中的CO2;NaOH、Na2CO3、Na3PO4;
(4)分析实验过程可知,V1为呼入的气体体积,V2为除净二氧化碳的呼入气体,V3为氮气的体积,C装置中溶液上方为50ml已除尽CO2的空气(N2和O2的体积比为4/1),氮气为40ml,氧气10ml,所以混合气体中CO2的体积为V1-V2,O2的体积为V2-V3-10,所以CO2与O2的体积比为(V1-V2):(V2-V3-10),若步骤⑤中C瓶还未冷却到室温就打开止水夹f,立即读出量筒D的读数,则读出的V3偏大,所以所测氧气的体积分数偏小,
故答案为:(V1-V2):(V2-V3-10);偏小.
点评 本题考查了物质组成的实验探究和实验设计方法,实验过程中的气体体积变化分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L N2含有的分子数为NA | |
| B. | 1mol•L-1 Al2(SO4)3溶液中含SO42-数目为3NA | |
| C. | 常温常压下,46g NO2含有氧原子数为2NA | |
| D. | 1mol Fe在足量Cl2中燃烧,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | (NH4)2 Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 澄清石灰水中加少量NaHCO3:Ca2++2 OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
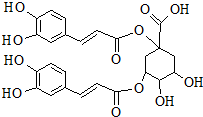 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )| A. | 1mol洋蓟素最多可与6molBr2反应 | |
| B. | 1mol洋蓟素最多可与7molNa2CO3反应 | |
| C. | 一定条件下能发生酯化反应和消去反应 | |
| D. | 1mol洋蓟素最多可与9molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com