
【题目】处理燃烧产生的烟道气CO和SO2,方法之一是在一定条件下将其催化转化为CO2和S。
已知:①2CO(g)+O2(g)![]() 2CO2(g) H=-566.0kJ/mol
2CO2(g) H=-566.0kJ/mol
②S(g)+O2(g)![]() SO2(g) H=-296.0kJ/mol
SO2(g) H=-296.0kJ/mol
下列说法中正确的是
A. 转化①有利于碳参与自然界的元素循环
B. 转化②中S和O2属于不同的核素
C. 可用澄清的石灰水鉴别CO2与SO2
D. 转化的热化学方程式是:2CO(g)+ SO2(g) ![]() S(s)+ 2CO2 (g) H =+270kJ/mol
S(s)+ 2CO2 (g) H =+270kJ/mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 无水CaCl2可用于干燥H2、Cl2和NH3
B. 无水硫酸铜与胆矾的相互转化属于化学变化
C. 代替传统火药鞭炮的“电子鞭炮”无任何的污染问题
D. 制造光导纤维的主要材料为晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中,不能大量共存的离子组是( )AC
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO![]()
b.2HCOOH+CO![]() =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO![]()
d.Cl2+H2O+2CO![]() =2HCO
=2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧的含量是衡量水质的一个重要指标,某实验兴趣小组通过如下步骤来测量水中溶解氧的含量:
步骤一:向溶解氧测量瓶中注入20.00 mL水样,再分别加入1 mL 0.1 mol L-1MnSO4溶液和3mL NaOH和KI的混合溶液,充分反应。此时发生反应的化学方程式为: Mn2++2OH-=Mn(OH)2↓ 2Mn(OH)2+ O2 =2MnO(OH)2
步骤二:向上述混合物中加入1.5 mL浓硫酸,充分反应后制沉淀完全溶解,此时溶液呈黄色。
步骤三:将溶液全部转移到容量瓶中,向其中滴加23滴淀粉溶液,溶液呈蓝色。用 0.005 mol L-1的Na2S2O3标准溶液滴定至蓝色恰好消失,共消耗Na2S2O3标准溶液3.60 mL。此时发生反应为:
I2+2Na2S2O3= 2NaI + Na2S4O6
(1)25 ℃时,步骤一中当加入NaOH使溶液的pH = 12时,此时溶液中的c(Mn2+)=_________mol L-1 。 (已知 KspMn(OH)2 =2.06×10-13)
(2)写出步骤二中所发生反应的化学方程式:______________________________。
(3)计算该水样中溶解氧的含量。(单位:mg L-1,请写出计算过程)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置进行试验
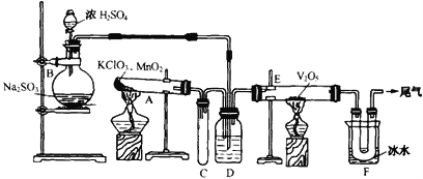
(1)烧瓶B内发生反应的化学方程式是________________。在本实验中,往往选择质量分数75%左右的浓硫酸,试分析其原因________________。
(2)小试管C的作用是________________。
(3)广口瓶D内盛的试剂是____________,装置D的3个作用是:①_________、②_______、③_________。
(4)玻璃管E内发生反应的化学方程式是________________。
(5)装置F中U形管中所收集物质的成分是________________。
(6)若U形管内收集到的物质很少,分析其原因不可能是______________(填序号)。
a、装置气密性不好
b、制得的SO2中混有少量H2S杂质使催化剂中毒;
c、气流速度过快。
(7)从U形管导出的尾气的处理方法是________________,相关反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com