
| A. | ②④ | B. | ①②④ | C. | ①③⑤ | D. | ②③⑤ |
分析 ①纯碱即碳酸钠属于盐;
②蔗糖在熔融时和溶液中都不导电,硫酸钡在溶液中完全电离,水能部分电离;
③分散系的分类依据是分散质微粒直径大小分析判断;
④化学反应中元素化合价发生变化是氧化还原反应的判断依据;
⑤碱性氧化物是指能与酸反应生成盐和水的金属氧化物.
解答 解:①纯碱即碳酸钠,是由钠离子和碳酸根离子构成的属于盐,不是碱,故①错误;
②蔗糖在熔融时和溶液中都不导电属于非电解质,硫酸钡在溶液中完全电离属于强电解质,水能部分电离属于弱电解质,故②正确;
③根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,丁达尔效应是胶体的性质不是本质特征,故③错误;
④化学反应中元素化合价是否发生变化把反应分为氧化还原反应和非氧化还原反应,故④正确;
⑤因过氧化钠与酸反应生成盐、水和氧气,则过氧化钠不属于碱性氧化物,故⑤错误;
故选A.
点评 本题考查物质的分类,注意物质的分类的依据,注意酸、碱、盐、氧化物、电解质、非电解质等概念的含义,题目难度不大.


科目:高中化学 来源: 题型:解答题
 Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | - |
| n(CO)/mol | 1.0 | - | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | - | - | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L CO2所含分子数为0.5 NA | |
| B. | 32gO2和O3的混合气体中含有的氧原子数为2NA | |
| C. | 标况下,11.2L乙醇(C2H5OH)中所含的碳原子数目为NA | |
| D. | 14.2 g Na2SO4固体中阴离子所带电荷数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Al+3CO2↑ | B. | CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;电解\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
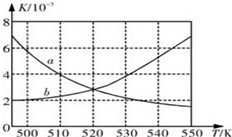
 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
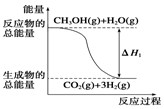 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:| A. | 1 mol CH3OH完全燃烧放出192.9 kJ热量 | |
| B. | 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程不一定要吸收能量 | |
| D. | 根据②推知:CH3OH(1)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| B. | 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 | |
| C. | 江河入海口常形成三角洲 | |
| D. | 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:PH3>H2S>HCl | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 酸性:HIO4>HBrO4>HClO4 | D. | 非金属性:F>O>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com