
分析 (1)加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成的二氧化碳与氢氧化钙溶液反应生成2.00g碳酸钙,根据n=$\frac{m}{M}$计算碳酸钙的物质的量,利用碳元素守恒计算二氧化碳的物质的量,根据V=nVm计算生成的二氧化碳的体积;
(2)根据方程式计算原混合物中碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,进而计算碳酸钠的质量;
(3)灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),再根据V=$\frac{n}{c}$计算需要盐酸的体积.
解答 解:(1)2.00g碳酸钙的物质的量为$\frac{2g}{100g/mol}$=0.02mol,根据碳元素守恒可知,n(CO2)=n(CaCO3)=0.02mol,故生成二氧化碳的体积为0.02mol×22.4L/mol=0.448L,
故答案为:0.448;
(2)加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,由方程式可知,
n(NaHCO3)=2n(CO2)=0.02mol×2=0.04mol,故碳酸氢钠的质量为0.04mol×84g/mol=3.36g,
故碳酸钠的质量为4.42g-3.36g=1.06g,
故答案为:1.06;3.36;
(3)原混合物中n(NaHCO3)=0.04mol,n(Na2CO3)=$\frac{1.06g}{106g/mol}$=0.01mol,灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),
故n(HCl)=n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.01mol×2+0.04mol=0.06mol,
故盐酸的物质的量浓度为$\frac{0.06mol}{0.03L}$=2mol/L,
故答案为:2.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe和 Cl2 | B. | Na2CO3与HCl | C. | NaOH与CO2 | D. | Na 和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
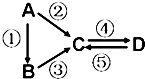 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
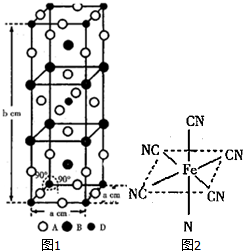
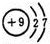
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
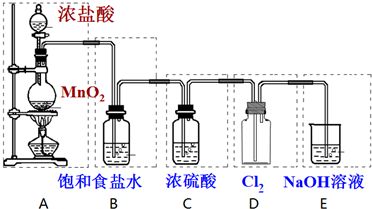
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
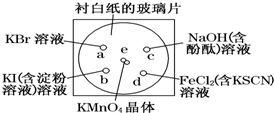 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com