
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.分析 (I)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;金属性越强,单质与水反应越剧烈;
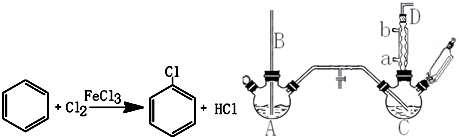
(II)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,以此解答.
解答 解:(I)由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;
金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是C,
故答案为:比较锂、钠、钾的金属性强弱;c;
(II)(1)利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,
故答案为:HNO3;Na2SiO3;CO2;
(2)烧杯中发生反应的离子方程式为:CO2+SiO32-+H2O═H2SiO3↓+CO32-,
故答案为:CO2+SiO32-+H2O=CO32-+H2SiO3↓;
(3)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,由实验可知酸性:硝酸大于碳酸,碳酸大于硅酸,则非金属性:N>C>Si;
故答案为:N>C>Si;
(4)因硝酸易挥发,则生成的二氧化碳气体中混有硝酸蒸气,则应用饱和碳酸氢钠除去硝酸,
故答案为:饱和NaHCO3.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | H2O | C. | NH4Cl(固体) | D. | CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com