
分析 (1)设Na、Mg、Al三种元素的质量分别23g、16g、9g,根据n=$\frac{m}{M}$计算各自物质的量,根据原子守恒计算NaCl、MgCl2、AlCl3的物质的量,进而计算三者物质的量之比;
(2)结合(1)中NaCl、MgCl2、AlCl3的物质的量之比,计算各物质的量的物质的量,再根据m=nM计算出混合物的质量.
解答 解:(1)设Na、Mg、Al三种元素的质量分别23g、16g、9g,则n(NaCl)=n(Na)=$\frac{23g}{23g/mol}$=1mol,
n(MgCl2)=n(Mg)=$\frac{16g}{24g/mol}$=$\frac{2}{3}$mol,
n(AlCl3)=n(Al)=$\frac{9g}{27g/mol}$=$\frac{1}{3}$mol,
故NaCl、MgCl2、AlCl3的物质的量的比为:1mol:$\frac{2}{3}$mol:$\frac{1}{3}$mol=3:2:1,
答:NaCl、MgCl2、AlCl3的物质的量的之比为3:2:1;
(2)设NaCl、MgCl2、AlCl3的物质的量分别为3x、2x、x,则3x+2x×2+x×3=1,解得x=0.1,
则混合物的质量为:58.5g/mol×0.1×3mol+95g/mol×0.1×2mol+133.5g/mol×0.1mol=49.9g,
答:氯原子为1mol时,混合物的质量为49.9g.
点评 本题考查混合物有关计算、物质的量计算,题目难度中等,注意掌握以物质的量为中心的有关计算,试题培养了学生的分析能力及化学计算能力.


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正化合价:N>S | B. | 热稳定性:HCl>HI | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下两种气体的体积之比等于物质的量之比 | |
| B. | 同温同压下两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同体积下两种气体的物质的量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3中原子数目为4NA | |
| B. | 100mL 1mol•L-1的K2CO3溶液中CO32-数目为0.1NA | |
| C. | 5.6g N2与足量H2反应,转移电子数目小于1.2NA | |
| D. | 9.1g苯和立方烷(C8H8)的混合物中原子数目为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
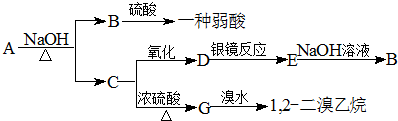
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
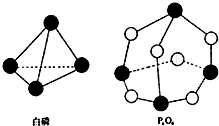 化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )| A. | 吸收126kJ的能量 | B. | 释放126kJ的能量 | ||
| C. | 吸收1638kJ的能量 | D. | 释放1638kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C ③比例模型为:  |
| B | ①由C、H两种元素组成; ②球棍模型为:  |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 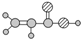 |
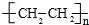 .
.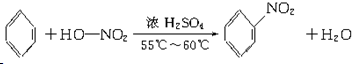 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com