
| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 | |
| B. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 常温常压下42g 乙烯和丁烯混合气体中,碳氢键的数目为6NA | |
| D. | 6.4g SO2与3.2g氧气反应生成SO3,转移电子数为0.2NA |
分析 A.一氧化氮与氧气反应生成二氧化氮,导致混合气体的分子数减少;
B.羟基中含有9个电子,氢氧根离子含有10个电子;
C.烯烃中极性键为碳氢键,乙烯和丁烯的最简式为CH2,根据最简式计算出混合物中含有碳氢键数目;
D.二氧化硫与氧气生成三氧化硫的反应为可逆反应,反应物不可能完全转化成生成物.
解答 解:A.标准状况下,11.2L混合气体的物质的量为0.5mol,由于O2和NO反应生成二氧化氮,导致气体分子数减少,混合物含有的分子数小于0.5×6.02×1023,故A错误;
B.1mol的羟基中含有9mol电子,1 mol的氢氧根离子含有10mol电子,所含电子数不同,故B错误;
C.42g乙烯和丁烯的混合物中含有3mol最简式CH2,含有6mol氢原子,烯烃中极性键为碳氢键,6mol氢原子形成了6mol碳氢极性键,所以混合气体中含有极性键数为6NA,故C正确;
D.6.4g二氧化硫的物质的量为0.1mol,0.1mol二氧化硫与氧气反应,由于该反应为可逆反应,则反应生成的三氧化硫小于0.1mol,转移的电子小于0.2mol,转移电子数小于0.2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确可逆反应特点,选项B为易错点,注意羟基与氢氧根离子的区别.


科目:高中化学 来源: 题型:多选题
| A. | 取a克混合物充分加热至质量不变,减重b克 | |
| B. | 取a克混合物与足量稀硝酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰完全吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
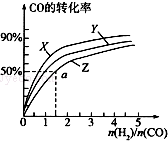 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 稀释浓硫酸时,应将浓硫酸沿器壁慢慢倒入量筒中的水中 | |
| D. | 用乙醇从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子组成相差1个或若干个CH2原子团的物质互称为同系物 | |
| B. | 相对分子质量相同的有机物是同分异构体 | |
| C. | 分子式相同、结构相同的有机物物理性质和化学性质一定相同 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com